Слайд 2
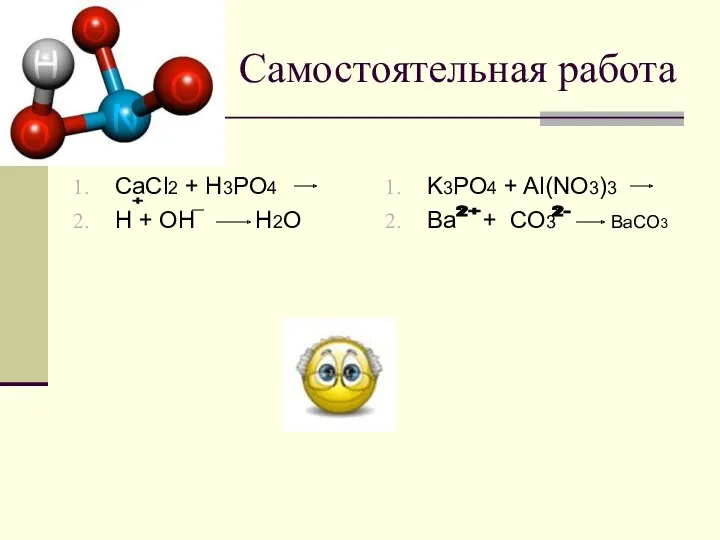
Самостоятельная работа
CaCl2 + H3PO4
H + OH H2O
K3PO4 + Al(NO3)3
Ba + CO3
Слайд 3

Подумай
Были ли у тебя вопросы при выполнении домашнего задания?
Трудно ли составлять
ионные уравнения?
Нет ли у тебя пробелов в знаниях по химии?
Ты всегда молодец?
Слайд 4
Слайд 5
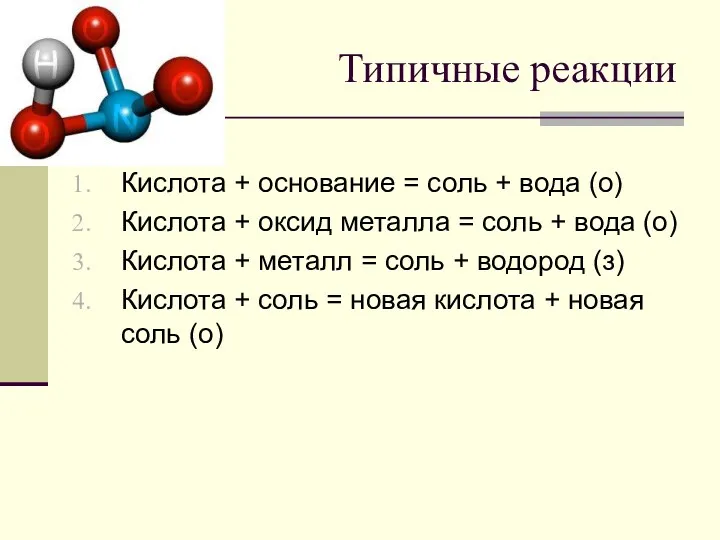
Типичные реакции
Кислота + основание = соль + вода (о)
Кислота + оксид
металла = соль + вода (о)
Кислота + металл = соль + водород (з)
Кислота + соль = новая кислота + новая соль (о)
Слайд 6

Лабораторный опыт №7
Тема: Реакции характерные для растворов кислот.
Цель: Изучить свойства растворов
кислот
Оборудование и реактивы: штатив,
пробирки, NaOH, HCl, ф-ф, Al, H2SO4, CuO, BaCl2
Ход работы:
Слайд 7

Реакция нейтрализации
Возьмите пробирку налейте 2-3 мл NaOH добавьте 1 каплю ф-ф,
что наблюдаете? Прилейте 2-3 мл HCl. Что вы увидели. Запишите уравнение реакции, протекающей в пробирке, его полное и сокращённое ионное уравнение.
Слайд 8

Кислота + оксид металла
Возьмите 1г оксида меди (2) и прилейте к
нему 2-3 мл серной кислоты. Нагрейте содержимое пробирки на спиртовке. Что вы наблюдаете? Запишите молекулярное уравнение реакции, полное и сокращённое ионное уравнение.
Слайд 9

Кислота + металл
Возьмите гранулу алюминия и прилейте к ней 2-3 мл
соляной кислоты. Что наблюдаете? Запишите уравнения реакции.
Как реагируют кислоты с металлами? Какие есть особенности?
Слайд 10

Кислота + соль
В пробирку налейте 2-3 мл хлорида бария и
прилейте 2-3 мл серной кислоты. Что вы наблюдаете запишите уравнения реакции.
Вывод: Какие свойства кислоты проявляют в растворе?
Слайд 11
Домашнее задание
§38 – «3»
№2 – «4»
№5 – «5»










 Презентация по теме Северный Кавказ (9 класс)
Презентация по теме Северный Кавказ (9 класс) Бытовые электротехнические товары
Бытовые электротехнические товары Консультация для родителей Развитие мелкой моторики рук для детей с нарушениями речи
Консультация для родителей Развитие мелкой моторики рук для детей с нарушениями речи Доработки ЕИС по переходу на применение ЕСКЛП версии 2.0. Закупка лекарственных препаратов
Доработки ЕИС по переходу на применение ЕСКЛП версии 2.0. Закупка лекарственных препаратов Ефимова Д
Ефимова Д Механические свойства грунтов
Механические свойства грунтов Вспомогательные репродуктивные технологии (ВРТ)
Вспомогательные репродуктивные технологии (ВРТ) Творческий проект Логарифмическая линейка
Творческий проект Логарифмическая линейка Групповой конфликт
Групповой конфликт Методический семинар
Методический семинар Disneyland is a dream of each child! Welcome to disneyland!!!
Disneyland is a dream of each child! Welcome to disneyland!!! Топочные устройства
Топочные устройства Формування національно-патріотичних цінностей молодших школярів у навчально-виховному процесі З Україною в серці…
Формування національно-патріотичних цінностей молодших школярів у навчально-виховному процесі З Україною в серці… Ешкі шаруашылығы
Ешкі шаруашылығы Григорий Богослов о догматике церкви
Григорий Богослов о догматике церкви Элементы автомобильных дорог и их влияние на безопасность дорожного движения. Тема №2
Элементы автомобильных дорог и их влияние на безопасность дорожного движения. Тема №2 Введение в теорию интеллектуальных информационных систем
Введение в теорию интеллектуальных информационных систем Зимний пейзаж
Зимний пейзаж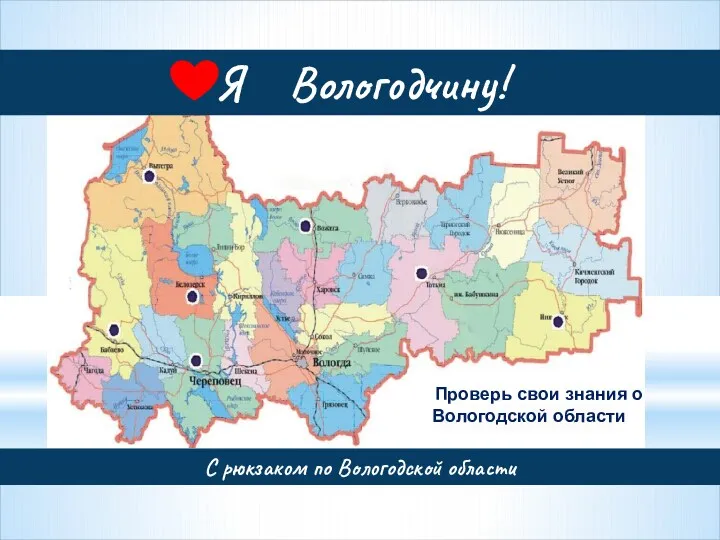 С рюкзаком по Вологодской области
С рюкзаком по Вологодской области Священная библейская история Нового Завета. Благовещение. Младшая группа
Священная библейская история Нового Завета. Благовещение. Младшая группа Традиции русской семьи: мудрость народного воспитания
Традиции русской семьи: мудрость народного воспитания Педагогический проект Формирование духовно-нравственных качеств детей на основе православной культуры и традиций русского народа.
Педагогический проект Формирование духовно-нравственных качеств детей на основе православной культуры и традиций русского народа. Пищевая аллергия у собак и кошек
Пищевая аллергия у собак и кошек Летающие динозавры
Летающие динозавры М. Горький. Легенда о Данко. (По рассказу Старуха Изергиль.)
М. Горький. Легенда о Данко. (По рассказу Старуха Изергиль.) Первичный туберкулез
Первичный туберкулез Презентация к методическому пособию
Презентация к методическому пособию Створення презентацій в Power Point
Створення презентацій в Power Point