Содержание
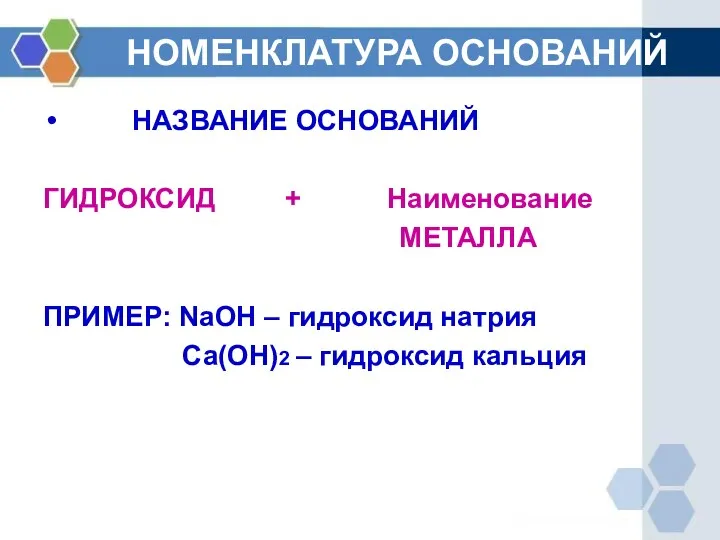
- 2. НОМЕНКЛАТУРА ОСНОВАНИЙ НАЗВАНИЕ ОСНОВАНИЙ ГИДРОКСИД + Наименование МЕТАЛЛА ПРИМЕР: NaOH – гидроксид натрия Ca(OH)2 – гидроксид
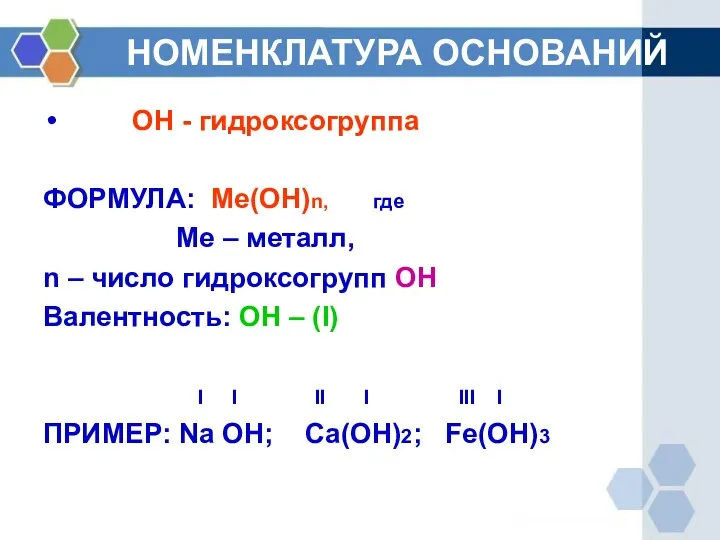
- 3. НОМЕНКЛАТУРА ОСНОВАНИЙ ОН - гидроксогруппа ФОРМУЛА: Ме(ОН)n, где Ме – металл, n – число гидроксогрупп ОН
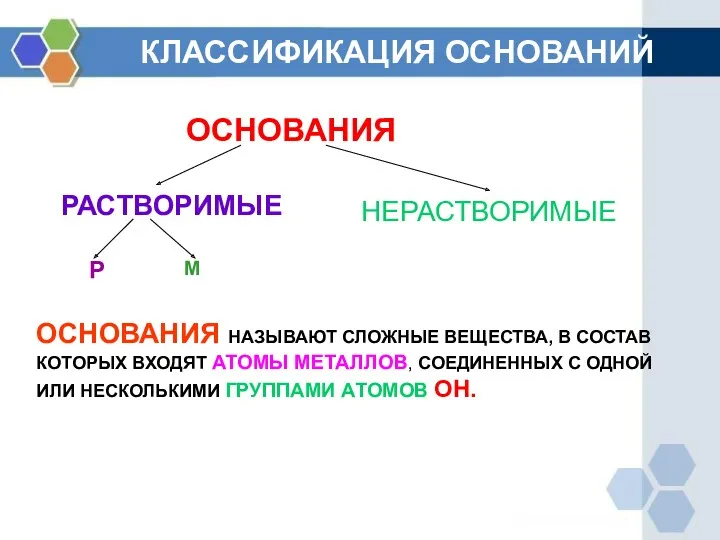
- 4. КЛАССИФИКАЦИЯ ОСНОВАНИЙ ОСНОВАНИЯ РАСТВОРИМЫЕ НЕРАСТВОРИМЫЕ Р М ОСНОВАНИЯ НАЗЫВАЮТ СЛОЖНЫЕ ВЕЩЕСТВА, В СОСТАВ КОТОРЫХ ВХОДЯТ АТОМЫ
- 5. НАПИСАТЬ ХИМИЧЕСКИЕ ФОРМУЛЫ ОСНОВАНИЙ 1)Гидроксид железа(III) 2)Гидроксид магния(II) 3) Гидроксид бария (II) 4) Гидроксид алюминия(III) 5)
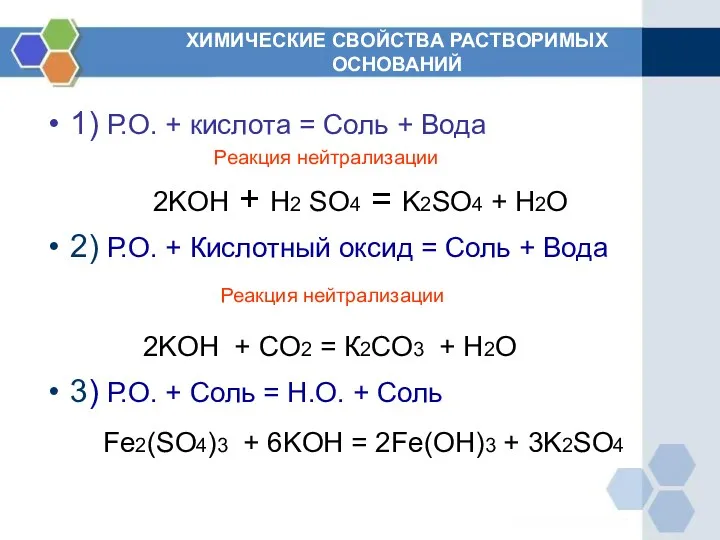
- 6. ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРИМЫХ ОСНОВАНИЙ 1) Р.О. + кислота = Соль + Вода Реакция нейтрализации 2KOH +
- 7. ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРИМЫХ ОСНОВАНИЙ 4) Действуют на индикаторы 5) при умеренном нагревании не разлагаются 6) разъедают
- 9. Скачать презентацию


 ГИА 2012 математика
ГИА 2012 математика Презентация Я здесь живу, и край мне этот дорог.История развития поселка Первомайский
Презентация Я здесь живу, и край мне этот дорог.История развития поселка Первомайский Цунами — длинные и высокие волны, порождаемые мощным воздействием на всю толщу воды в океане или другом водоёме
Цунами — длинные и высокие волны, порождаемые мощным воздействием на всю толщу воды в океане или другом водоёме Категорирование объектов транспортной инфраструктуры и транспортных средств железнодорожного транспорта
Категорирование объектов транспортной инфраструктуры и транспортных средств железнодорожного транспорта Пропорции тела человека. Задачи
Пропорции тела человека. Задачи Презентация по теме Синтетические моющие средства
Презентация по теме Синтетические моющие средства Виды сварных соединений и швов
Виды сварных соединений и швов Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Едет, плывет, летит. Для детей 4 - 5 лет
Едет, плывет, летит. Для детей 4 - 5 лет Первый раз в первый класс!
Первый раз в первый класс! Городское и сельское население. Урбанизация, как всемирный процесс. (10 класс)
Городское и сельское население. Урбанизация, как всемирный процесс. (10 класс) методическая разработка учебной программы 5 класс
методическая разработка учебной программы 5 класс Становление и развитие земельного законодательства в России
Становление и развитие земельного законодательства в России Основные термины и определения. Развитие ЦЭВМ и МП. (Лекция 1)
Основные термины и определения. Развитие ЦЭВМ и МП. (Лекция 1) Мастер класс Ашамлыклар кибетендә
Мастер класс Ашамлыклар кибетендә Презентация Развитие игровой деятельности дошкольника в условиях ФГОС дошкольного образования
Презентация Развитие игровой деятельности дошкольника в условиях ФГОС дошкольного образования Неорганические вяжущие вещества
Неорганические вяжущие вещества Республика Дагестан и Чеченская Республика
Республика Дагестан и Чеченская Республика Презентация для педагогов
Презентация для педагогов Модем как прорыв в будущее!
Модем как прорыв в будущее! Характеристика спиртов.
Характеристика спиртов. БЛК (Бағдарламаланатын логикалық контроллер) құрылымы
БЛК (Бағдарламаланатын логикалық контроллер) құрылымы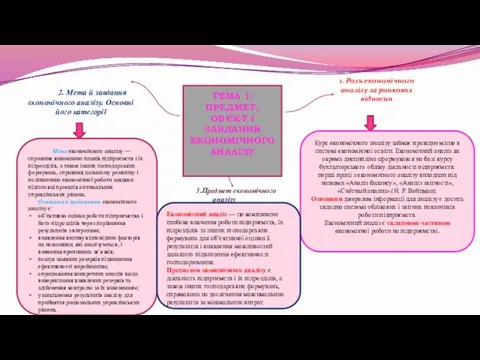 Предмет, об'єкт і завдання економічного аналізу. (Тема 1)
Предмет, об'єкт і завдання економічного аналізу. (Тема 1) Дома - живые свидетели истории
Дома - живые свидетели истории История русского литературного языка
История русского литературного языка Оптимальный режим труда и отдыха
Оптимальный режим труда и отдыха Японская чайная церемония
Японская чайная церемония презентация проекта Что такое новый год
презентация проекта Что такое новый год