Содержание
- 2. Цели и задачи : узнать о представителях класса спиртов, их классификации изучить изомерию и номенклатуру класса.
- 3. Спирты: классификация, изомерия, номенклатура Спирты – производные углеводородов, в молекулах которых один или несколько атомов водорода
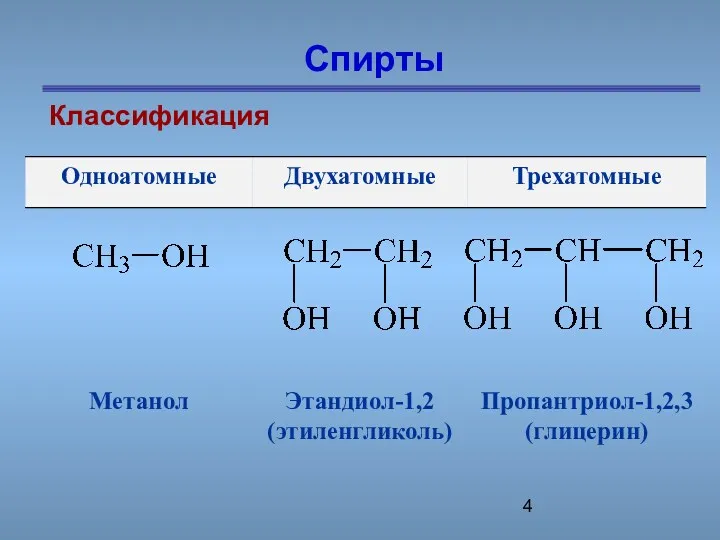
- 4. Спирты Классификация
- 5. классификация По количеству функциональных групп –ОН Одноатомные и многоатомные.
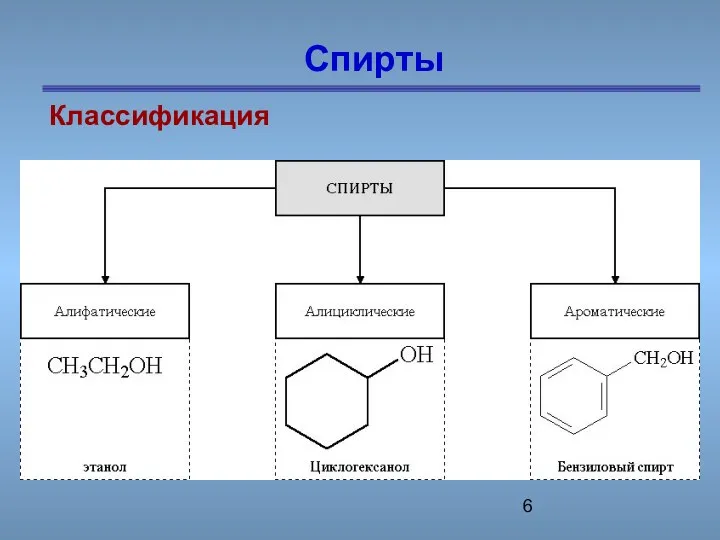
- 6. Спирты Классификация
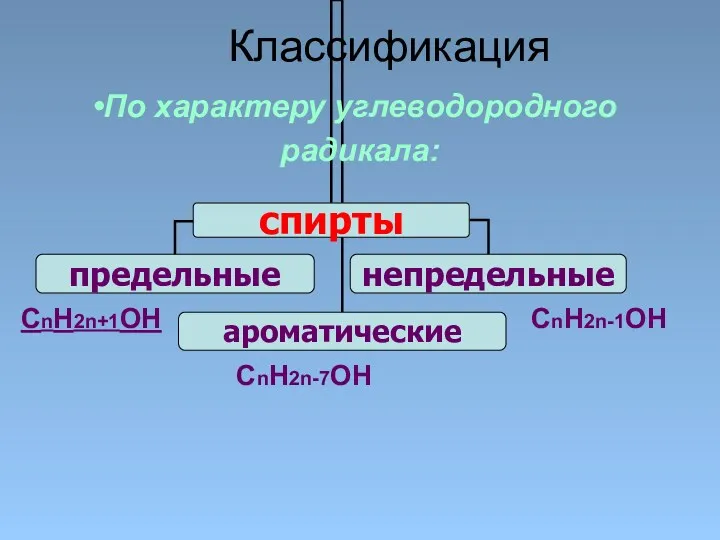
- 7. Классификация По характеру углеводородного радикала: СnH2n+1OH CnH2n-7OH CnH2n-1OH
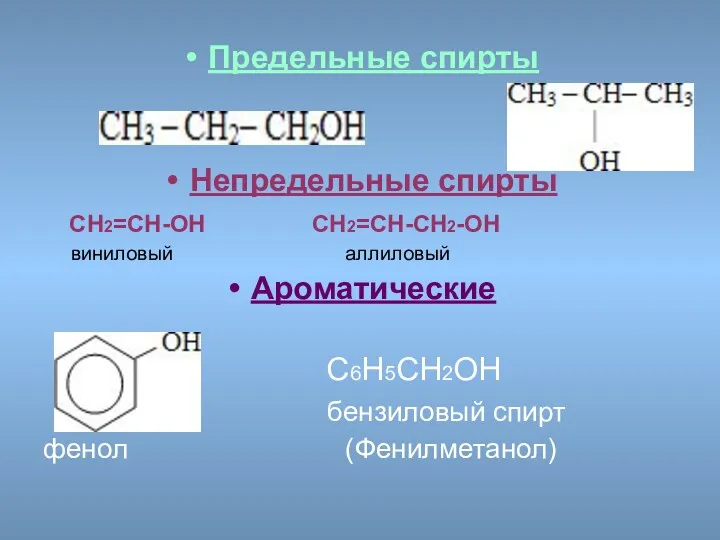
- 8. Предельные спирты Непредельные спирты СН2=СН-ОН СН2=СН-СН2-ОН виниловый аллиловый Ароматические С6Н5СН2ОН бензиловый спирт фенол (Фенилметанол)
- 9. Непредельным одноатомным спиртом является витамин А, важнейшая биологическая функция которого – участие в зрительном процессе. А
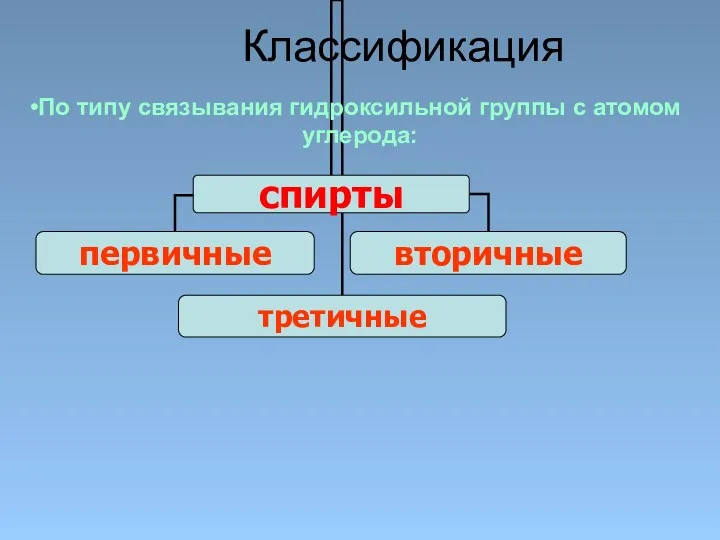
- 10. Классификация По типу связывания гидроксильной группы с атомом углерода:
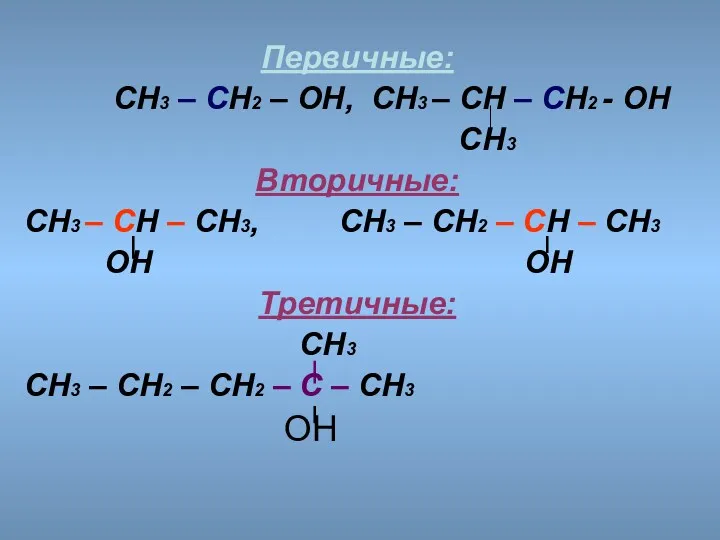
- 11. Первичные: СН3 – СН2 – ОН, СН3 – СН – СН2 - ОН СН3 Вторичные: СН3
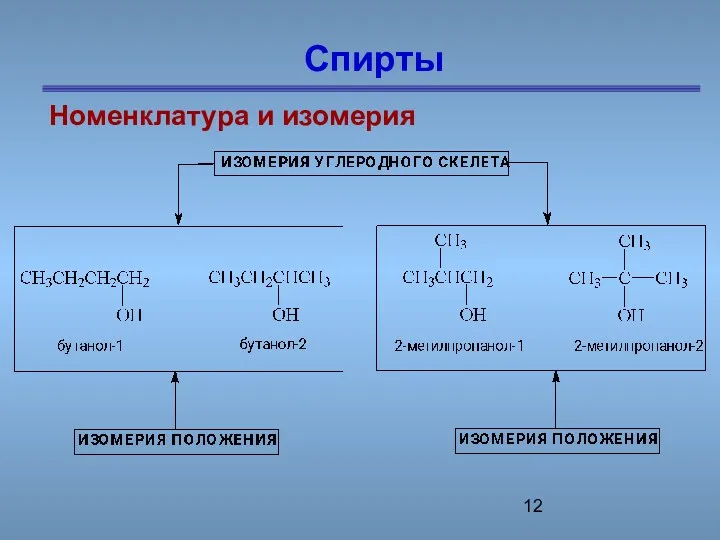
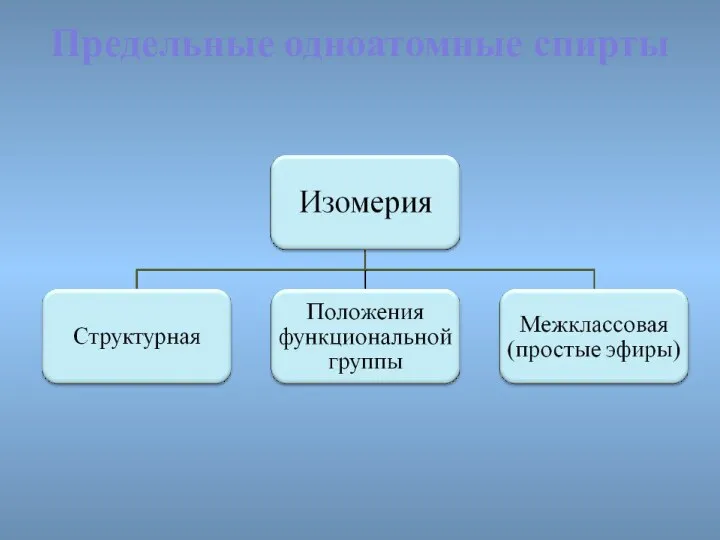
- 12. Спирты Номенклатура и изомерия
- 13. изомерия Межклассовая изомерия этанол CH3-CH2-OH и диметиловый эфир CH3 – О – CH3
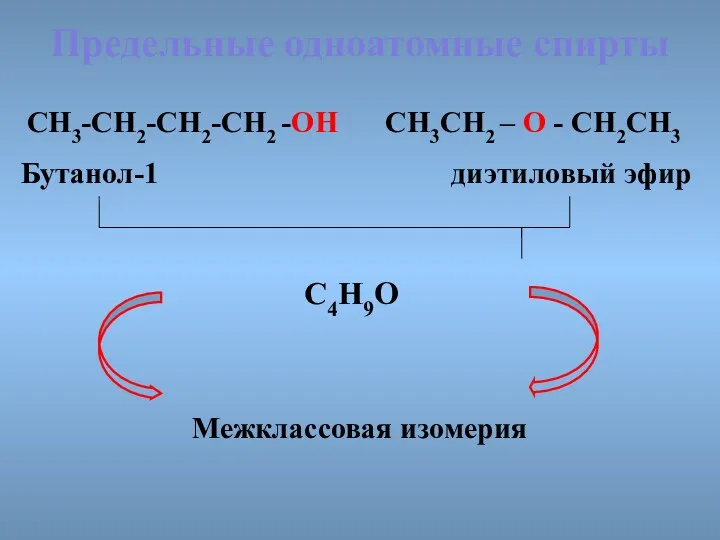
- 14. СН3СН2 – О - СН2СН3 Предельные одноатомные cпирты Бутанол-1 диэтиловый эфир СН3-СН2-СН2-СН2 -ОН С4Н9О Межклассовая изомерия
- 15. Предельные одноатомные cпирты
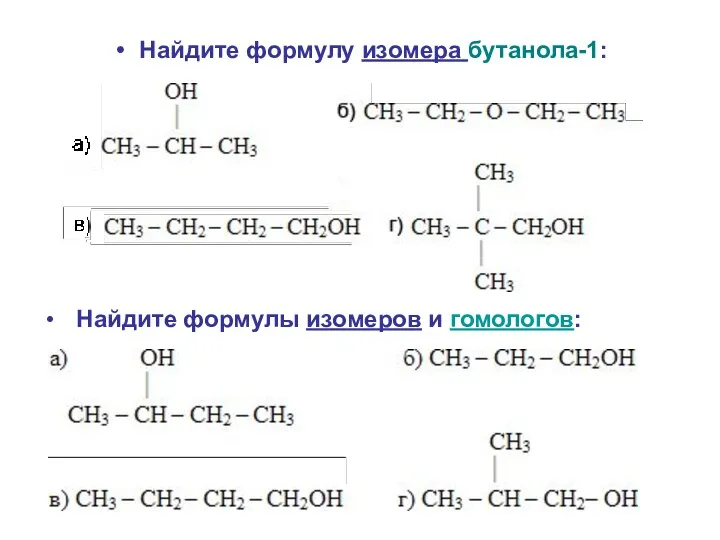
- 16. Найдите формулу изомера бутанола-1: Найдите формулы изомеров и гомологов:
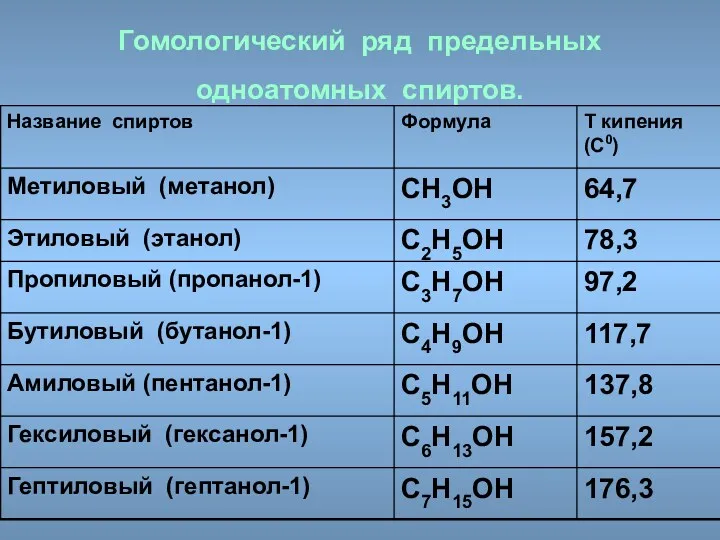
- 17. Гомологический ряд предельных одноатомных спиртов.
- 18. номенклатура Обратите внимание на особенности номенклатуры спиртов: • Самая длинная цепочка атомов углерода номеруется с того
- 19. • После суффикса ставится цифра, указывающая на положение гидроксильной группы. пропанол – 1, пропанол – 2…
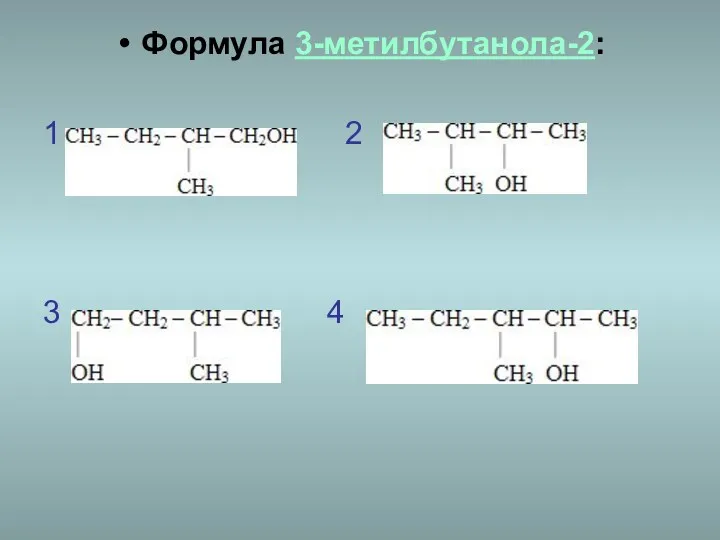
- 20. Формула 3-метилбутанола-2: 1 2 3 4
- 21. Тест. Даны вещества: 2-метилбутанол-2, пентанол-2, пропилэтиловый эфир, 2-метилбутанол-1, 2,2-диметилпропанол-1. Найти изомеры пентанола-1 и составить структурные формулы.
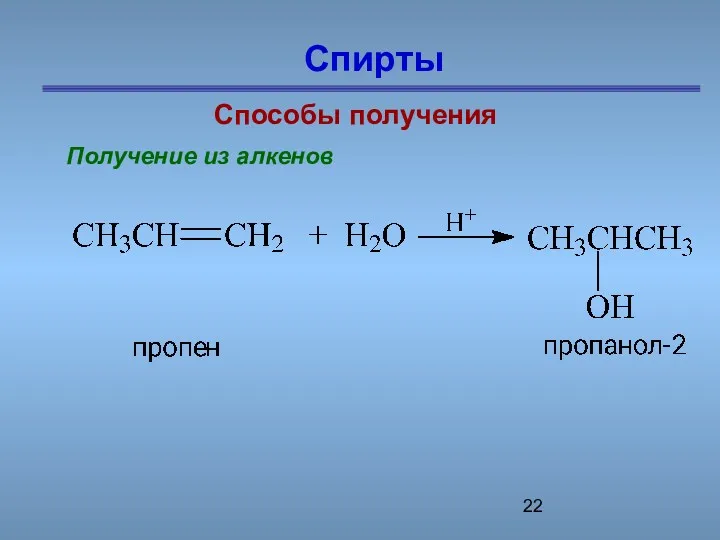
- 22. Спирты Способы получения Получение из алкенов
- 23. Спирты Способы получения Получение из галогенпроизводных
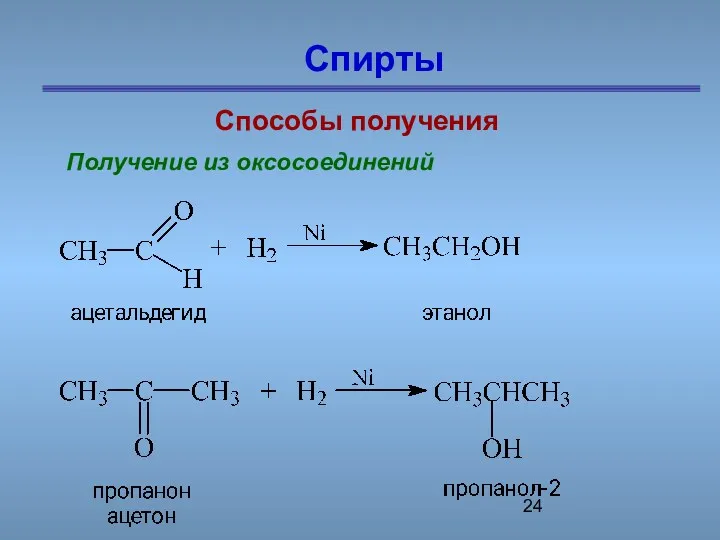
- 24. Спирты Способы получения Получение из оксосоединений
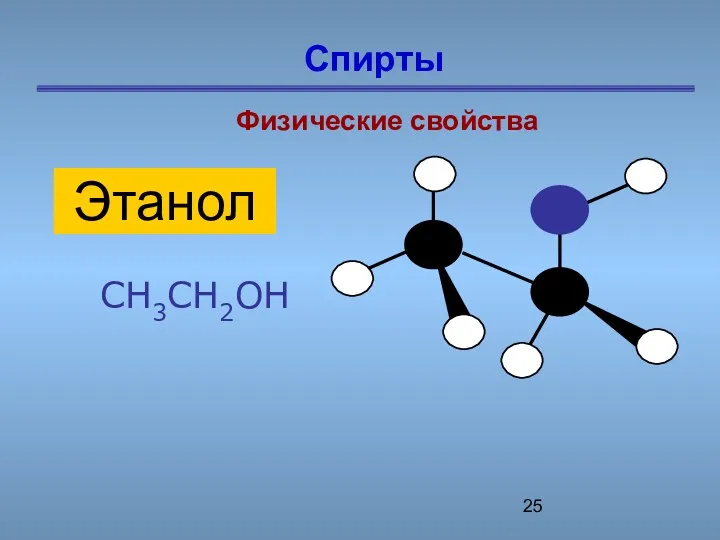
- 25. Спирты Физические свойства CH3CH2OH Этанол
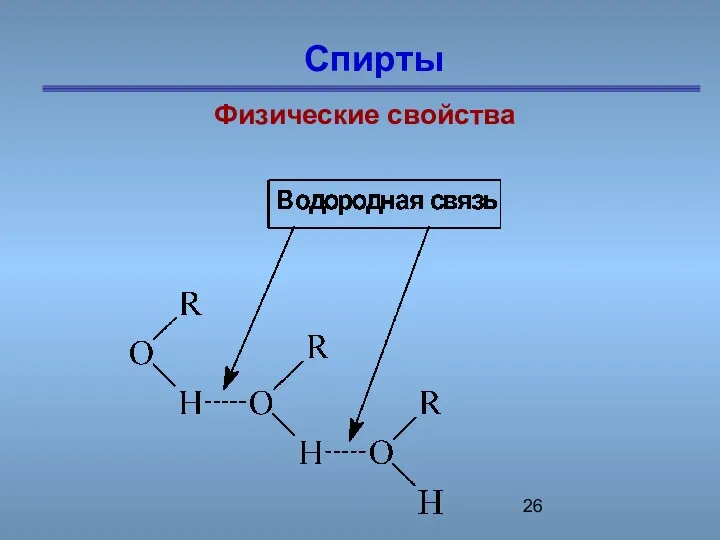
- 26. Спирты Физические свойства
- 27. Предельные одноатомные cпирты …О - Н …О - Н …О - Н …О - Н …О
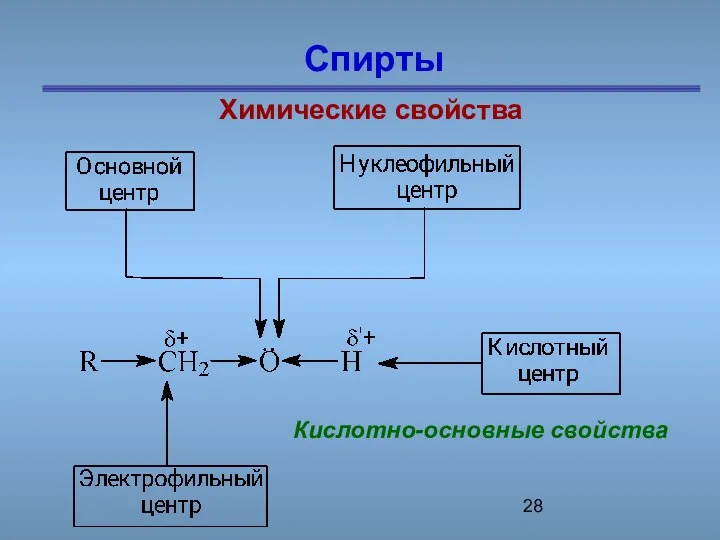
- 28. Спирты Химические свойства Кислотно-основные свойства
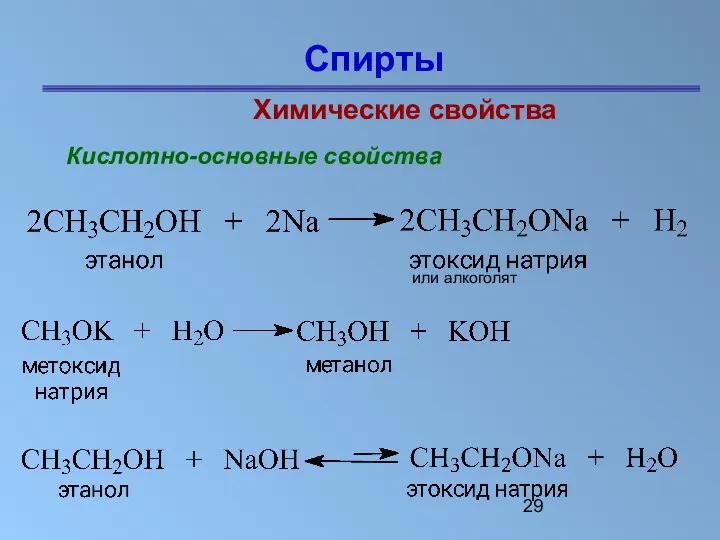
- 29. Спирты Химические свойства Кислотно-основные свойства или алкоголят
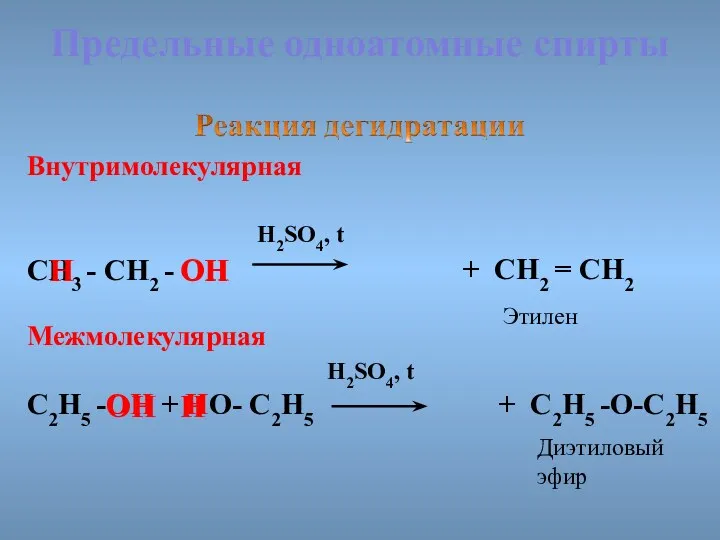
- 30. Предельные одноатомные cпирты Внутримолекулярная H2SO4, t СН3 - СН2 - ОН ОН Межмолекулярная H2SO4, t С2Н5
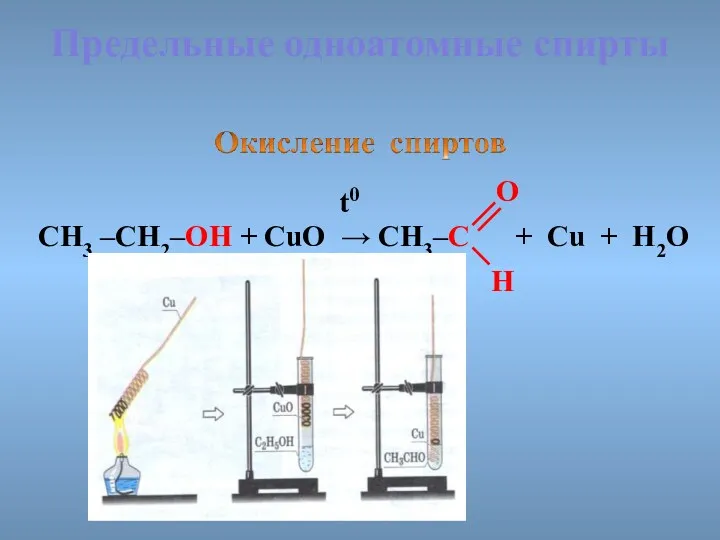
- 31. Предельные одноатомные cпирты CH3 –CH2–OH + CuO → CH3–C + Cu + H2O t0 O H
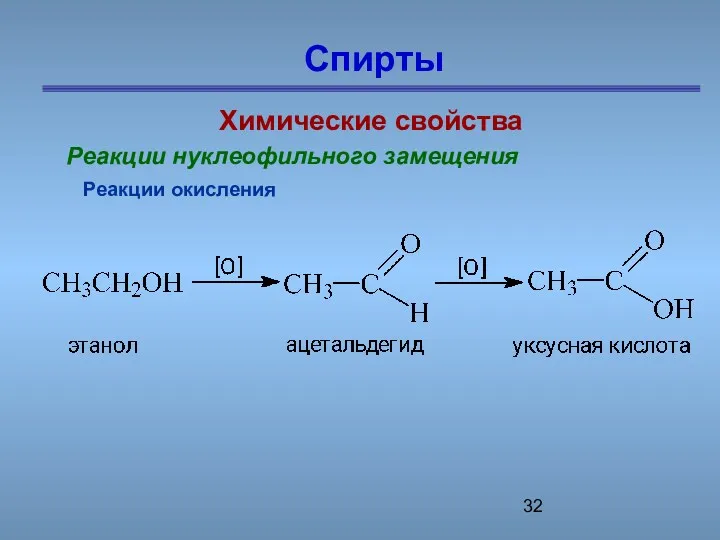
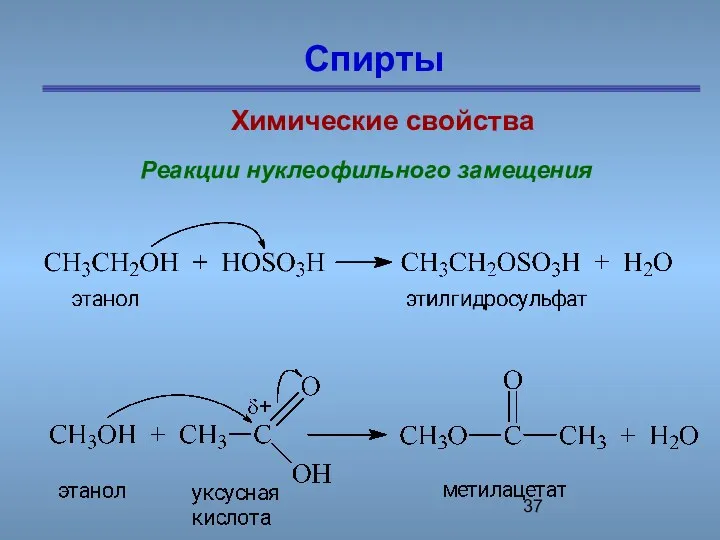
- 32. Спирты Химические свойства Реакции нуклеофильного замещения Реакции окисления
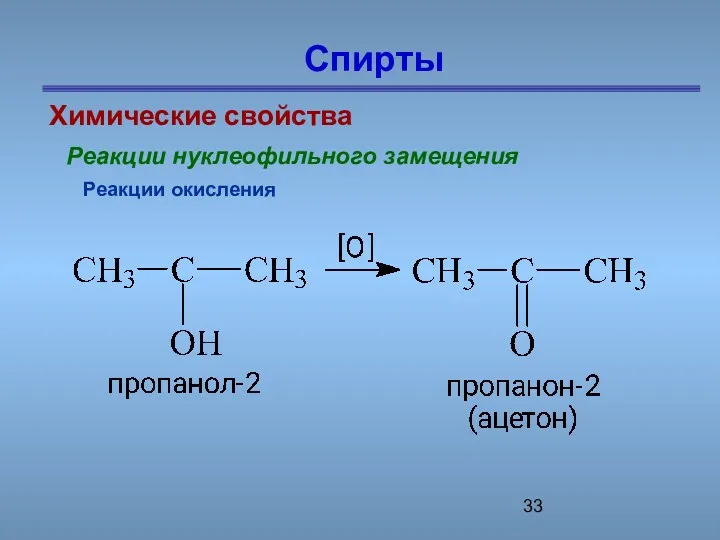
- 33. Спирты Химические свойства Реакции нуклеофильного замещения Реакции окисления
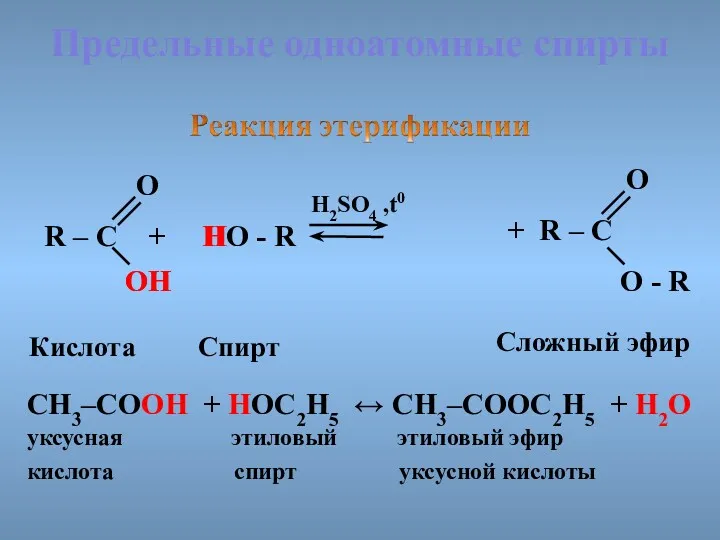
- 34. Предельные одноатомные cпирты R – C + HO - R H2SO4 ,t0 O ОH OH H
- 35. Спирты Химические свойства Реакции замещения Взаимодействии спиртов с галогенопроизводными
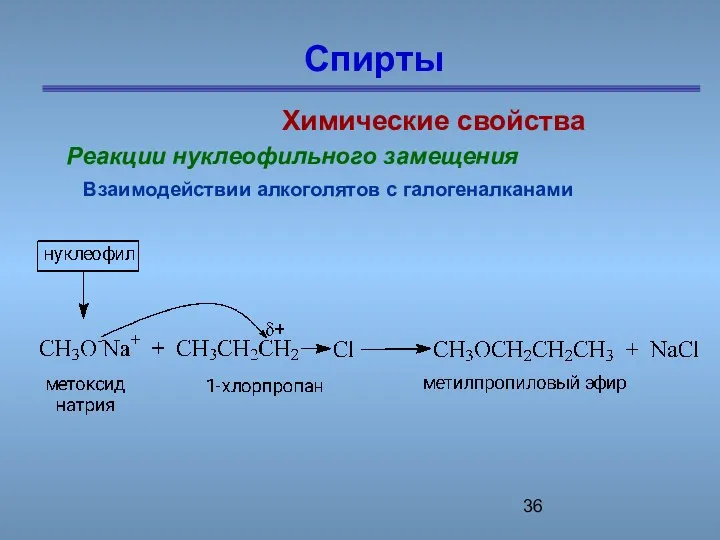
- 36. Спирты Химические свойства Реакции нуклеофильного замещения Взаимодействии алкоголятов с галогеналканами
- 37. Спирты Химические свойства Реакции нуклеофильного замещения
- 38. Предельные одноатомные cпирты
- 39. Предельные одноатомные cпирты
- 41. Предельные одноатомные cпирты
- 42. Cu(OH)2 глицерин СН2 - СН2 ОН ОН этиленгликоль СН2 – СН - СН2 ОН ОН ОН
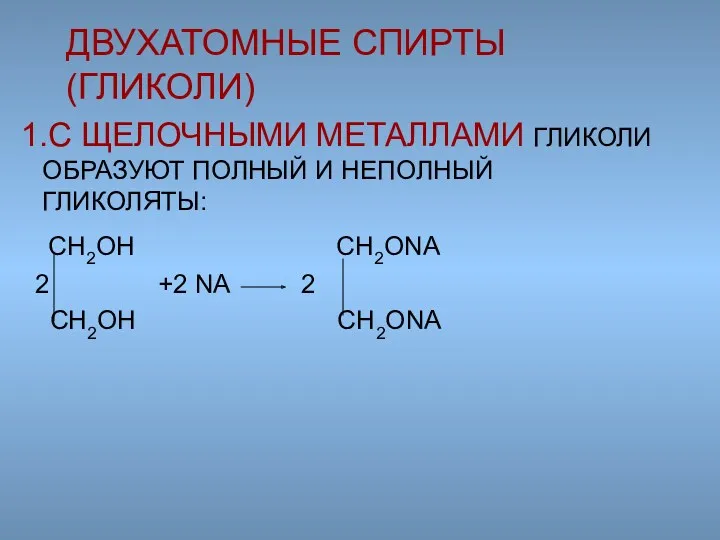
- 43. 1.С ЩЕЛОЧНЫМИ МЕТАЛЛАМИ ГЛИКОЛИ ОБРАЗУЮТ ПОЛНЫЙ И НЕПОЛНЫЙ ГЛИКОЛЯТЫ: CH2OH CH2ONA 2 +2 NA 2 CH2OH
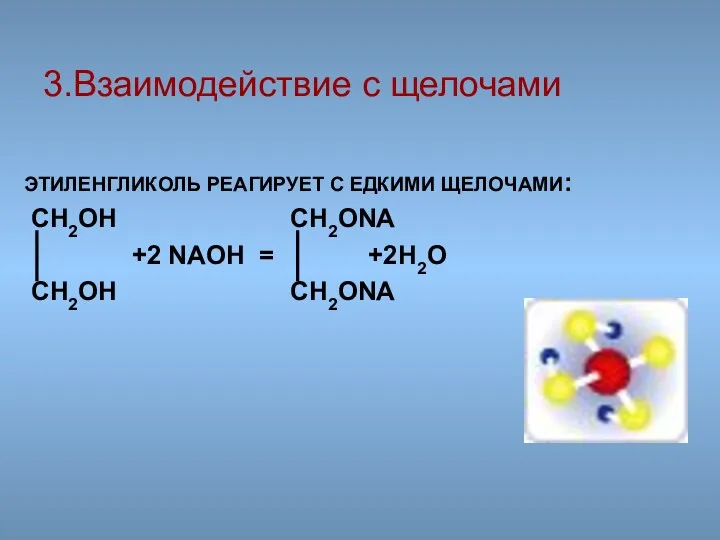
- 44. ЭТИЛЕНГЛИКОЛЬ РЕАГИРУЕТ С ЕДКИМИ ЩЕЛОЧАМИ: CH2OH CH2ONA +2 NAOH = +2H2O CH2OH CH2ONA 3.Взаимодействие с щелочами
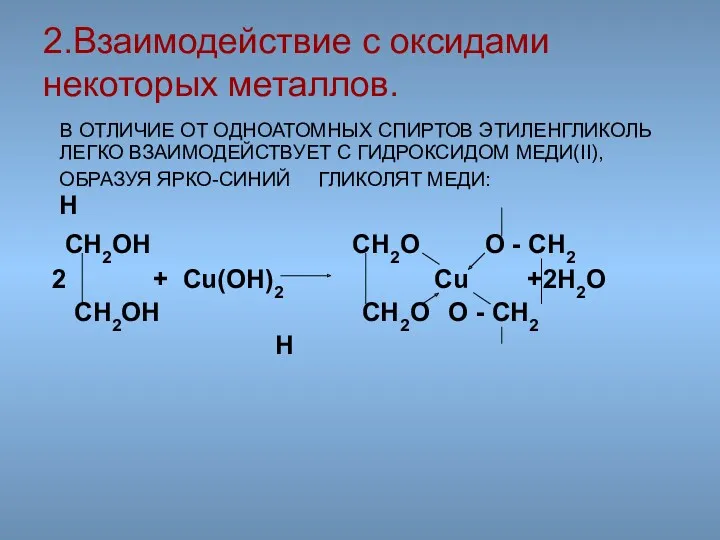
- 45. В ОТЛИЧИЕ ОТ ОДНОАТОМНЫХ СПИРТОВ ЭТИЛЕНГЛИКОЛЬ ЛЕГКО ВЗАИМОДЕЙСТВУЕТ С ГИДРОКСИДОМ МЕДИ(II), ОБРАЗУЯ ЯРКО-СИНИЙ ГЛИКОЛЯТ МЕДИ: H
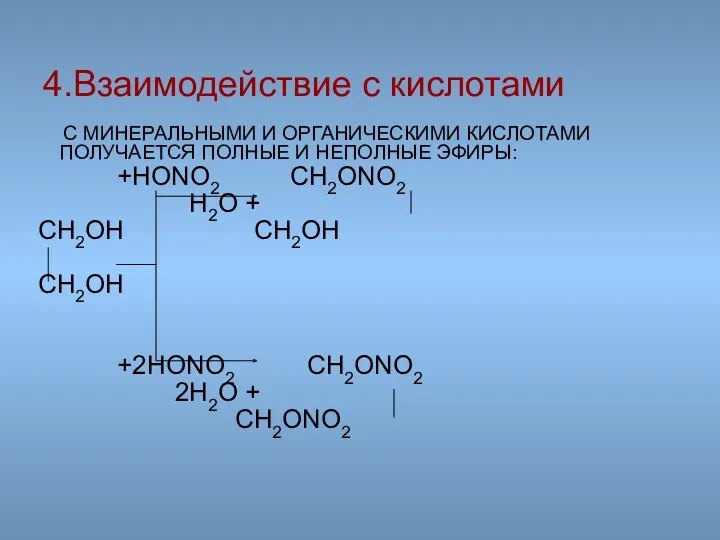
- 46. С МИНЕРАЛЬНЫМИ И ОРГАНИЧЕСКИМИ КИСЛОТАМИ ПОЛУЧАЕТСЯ ПОЛНЫЕ И НЕПОЛНЫЕ ЭФИРЫ: +HONO2 CH2ONO2 H2O + CH2OH CH2OH
- 47. ПО ХИМИЧЕСКИМ СВОЙСТВАМ ГЛИЦЕРИН ОЧЕНЬ БЛИЗОК К ЭТИЛЕНГЛИКОЛЮ.ТАК, С ГИДРОКСИДОМ МЕДИ(II) ГЛИЦЕРИН ОБРАЗУЕТ ЯРКО-СИНИЙ ГЛИЦЕРАТ МЕДИ:
- 48. При взаимодействии глицерина с неорганическими и органическими кислотами получаются полные и неполные сложные эфиры. CH2OH CH2ONO2
- 50. Скачать презентацию


















 Машины для измельчения материалов
Машины для измельчения материалов Аттестация педагогов.Нормативно-правовое обеспечение Диск
Аттестация педагогов.Нормативно-правовое обеспечение Диск Артикуляционная гимнастика. Звук С. Презентация
Артикуляционная гимнастика. Звук С. Презентация Правовые основы брака и семьи
Правовые основы брака и семьи Шарль де Голль
Шарль де Голль Цитомегалоловирустар, хламидиялық герпестік инфекция және жүктілік
Цитомегалоловирустар, хламидиялық герпестік инфекция және жүктілік Проект “Кто твой герой?”
Проект “Кто твой герой?” Интеллектуальная игра Звездный час
Интеллектуальная игра Звездный час Научно - исследовательская работа Чудо - шоколад
Научно - исследовательская работа Чудо - шоколад Релейная защита и автоматизация электроэнергетических систем
Релейная защита и автоматизация электроэнергетических систем INTL 101. Friday A05 & A06. INTL 101. Friday A05 & A06
INTL 101. Friday A05 & A06. INTL 101. Friday A05 & A06 Школьные годы чудесные. Советы новоиспечённым педагогам
Школьные годы чудесные. Советы новоиспечённым педагогам Композиция. Пропорции. Клетка
Композиция. Пропорции. Клетка Рак ободочной кишки
Рак ободочной кишки Как правильно подготовить ребёнка к школе
Как правильно подготовить ребёнка к школе Легкие бетоны
Легкие бетоны О вреде использованных батареек для окружающей среды
О вреде использованных батареек для окружающей среды физ.минутки на уроках
физ.минутки на уроках Выход проекта Я и моя Воркута
Выход проекта Я и моя Воркута Презентация Сахароза
Презентация Сахароза Родительское собрание Мой ребёнок - левша
Родительское собрание Мой ребёнок - левша Учимся определять время по часам
Учимся определять время по часам Семейные праздники
Семейные праздники Технологическая прочность сварных соединений
Технологическая прочность сварных соединений Научная конференция на тему Мировые экологические проблемы
Научная конференция на тему Мировые экологические проблемы Теплоснабжение городов и зданий (Тема 6)
Теплоснабжение городов и зданий (Тема 6) I Вселенский Собор в Никее
I Вселенский Собор в Никее Роль женщины в современном мире
Роль женщины в современном мире