Содержание
- 2. Заполните пропуски, проанализировав записи.
- 3. Заполните пропуски, проанализировав записи. 4 3 2 4 3 2 27 32 102 108 96 204
- 4. Заполните пропуски (самостоятельно). Если в реакцию вступит 2 моль алюминия, то потребуется ? моль кислорода, ?
- 5. Осуществите самопроверку и самооценку Если в реакцию вступит 2 моль алюминия, то потребуется 1,5 моль кислорода,
- 6. Расчёты по уравнениям неорганических реакций
- 7. Выводы Химическое уравнение показывает не только качественную сторону процесса, но (что очень важно!) и количественную сторону
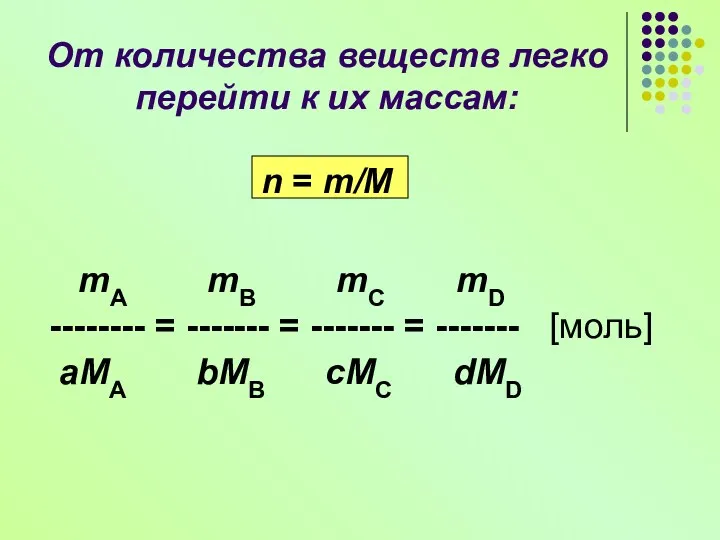
- 8. Пусть дано уравнение химической реакции: aA + bB = cC + dD тогда выполняется соотношение nA
- 9. mA mB mC mD -------- = ------- = ------- = ------- [моль] aMA bMB cMC dMD
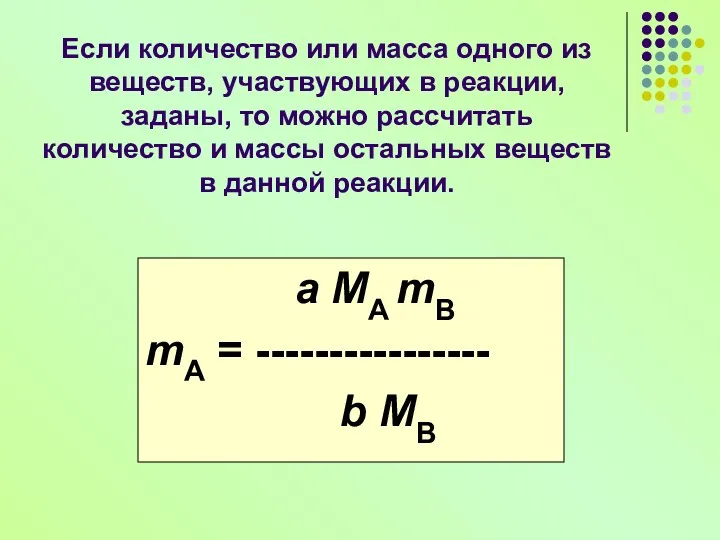
- 10. Если количество или масса одного из веществ, участвующих в реакции, заданы, то можно рассчитать количество и
- 11. Для газообразных веществ чаще задают или определяют их объёмы. Если реагент В и продукт D –
- 12. Зная одно из значений (VB или VD, а для веществ А и С – mA или
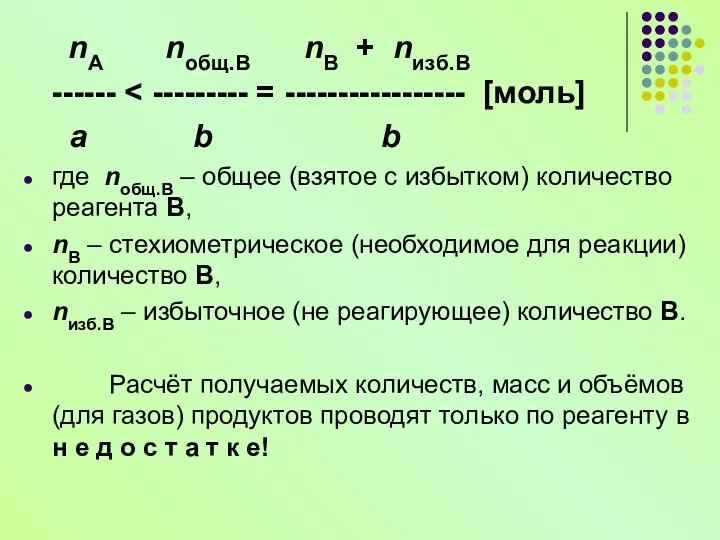
- 13. Расчёты по уравнениям реакций на «избыток» и «недостаток» Количества, массы и объёмы (для газов) реагентов не
- 14. nА nобщ.В nВ + nизб.В ------ a b b где nобщ.В – общее (взятое с избытком)
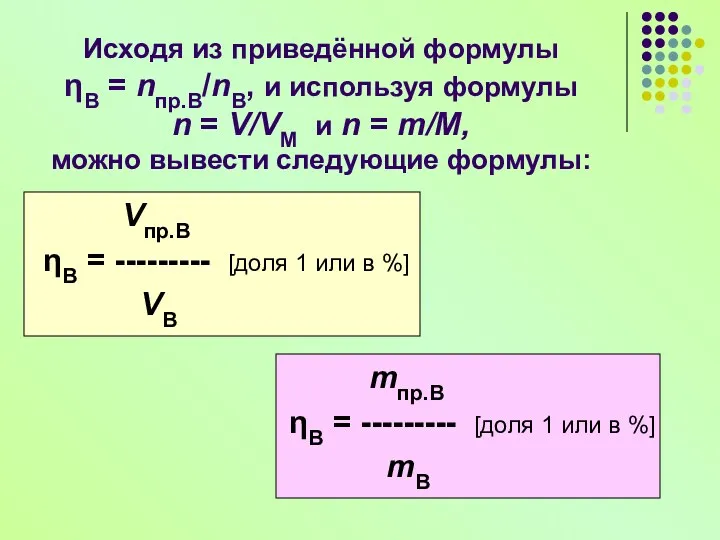
- 15. Расчёты по уравнениям реакций на практический выход продукта Количество продукта, например В, рассчитанное по уравнению реакции,
- 16. Исходя из приведённой формулы ηВ = nпр.В/nВ, и используя формулы n = V/VМ и n =
- 17. Задача 1 Вычислите объём кислорода (н. у.), необходимый для сжигания 3 г алюминия. (Такая реакция происходит
- 18. Р е ш е н и е 4Al + 3O2 = 2Al2O3 (А) (В) VВ =
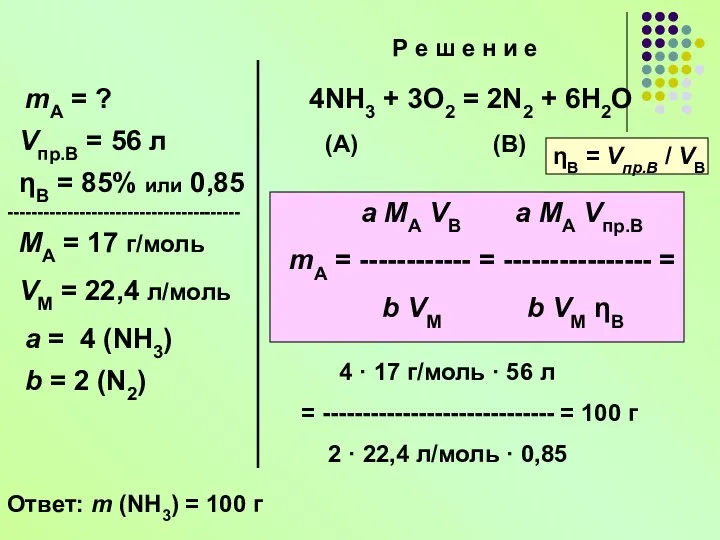
- 19. Задача 2 При сгорании аммиака в избытке кислорода после охлаждения конечной смеси обнаружено 56 л (н.
- 20. a MА VB a MA Vпр.В mA = ------------ = ---------------- = b VМ b VМ
- 21. Итог урока — Выразите в виде формулы отношения количеств веществ, участвующих в химической реакции, к их
- 23. Скачать презентацию















 1С:КАССА. Доступная онлайн-касса с облачной системой товароучета для малой розницы
1С:КАССА. Доступная онлайн-касса с облачной системой товароучета для малой розницы Первые христиане
Первые христиане Как пользоваться сайтом i-exem
Как пользоваться сайтом i-exem Непредельные углеводороды
Непредельные углеводороды Русские народные музыкальные инструменты
Русские народные музыкальные инструменты Операции на пищеводе, показание, виды
Операции на пищеводе, показание, виды Разработка 10-балльной шкалы оценки степени обученности обучающегося по преподаваемому предмету
Разработка 10-балльной шкалы оценки степени обученности обучающегося по преподаваемому предмету Техника и технологии в сельском хозяйстве. Агроинженерия. Лекция 1
Техника и технологии в сельском хозяйстве. Агроинженерия. Лекция 1 Презентация педагогического опыта
Презентация педагогического опыта Рабочая неделя Главы Тракторозаводского района
Рабочая неделя Главы Тракторозаводского района Микеланджело Буонарроти (1475 – 1564)
Микеланджело Буонарроти (1475 – 1564) Забытая война. К 100-летию начала Первой мировой войны
Забытая война. К 100-летию начала Первой мировой войны Динамика мирового потребления энергоресурсов. Лекция 1
Динамика мирового потребления энергоресурсов. Лекция 1 Имандылық жарасады ұл-қызға
Имандылық жарасады ұл-қызға Производные пиррозилидина. (Лекция 6)
Производные пиррозилидина. (Лекция 6) Цветок
Цветок Породы крупного рогатого скота молочного направления
Породы крупного рогатого скота молочного направления Организация образовательного пространства дошкольной образовательной организации в соответствии с ФГОС
Организация образовательного пространства дошкольной образовательной организации в соответствии с ФГОС Фотоальбом. Для Алексея
Фотоальбом. Для Алексея Каталог тканей. Оплата и доставка
Каталог тканей. Оплата и доставка История Военно-Морского Флота Российской Федерации
История Военно-Морского Флота Российской Федерации Порты ввода-вывода
Порты ввода-вывода Нормативно-правовые акты, гарантирующие право получения детям с ограниченными возможностями здоровья адекватного их возможностям образования
Нормативно-правовые акты, гарантирующие право получения детям с ограниченными возможностями здоровья адекватного их возможностям образования 20231203_zapovedniki-russia
20231203_zapovedniki-russia План-конспект и презентация классного часа на тему Все профессии нужны, все профессии важны!
План-конспект и презентация классного часа на тему Все профессии нужны, все профессии важны! Комплексные числа. Модуль и аргумент комплексного числа
Комплексные числа. Модуль и аргумент комплексного числа Экскурсия Улицы родного села.
Экскурсия Улицы родного села. Многофункциональный жилой дом
Многофункциональный жилой дом