Содержание
- 2. Цели: Изучить новый класс органических соединений – алкины, рассмотреть физические и химические свойства, способы получения ацетилена
- 3. Химическая разминка Что такое углеводороды? Какие углеводороды относятся к непредельным? Что такое алкины? Что такое гибридизация?
- 4. Назовите вещество CH₃ CH₃ І І CH ≡ C — C — C H ₂ —
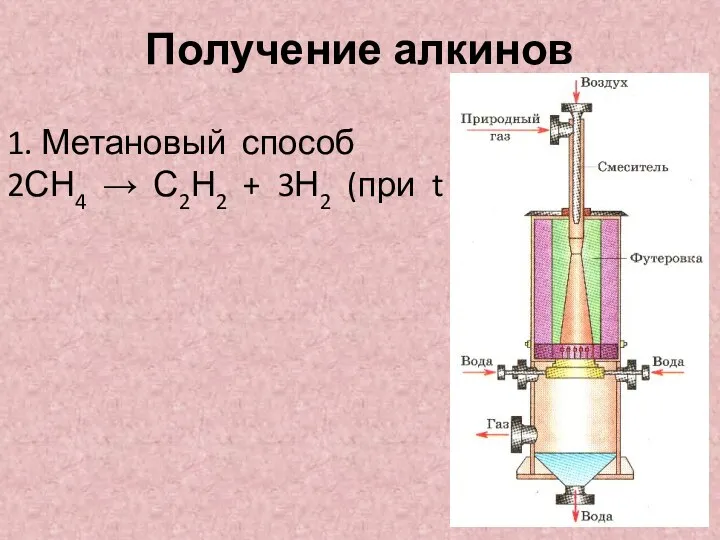
- 5. Получение алкинов 1. Метановый способ 2СН4 → С2Н2 + 3Н2 (при t =15000С)
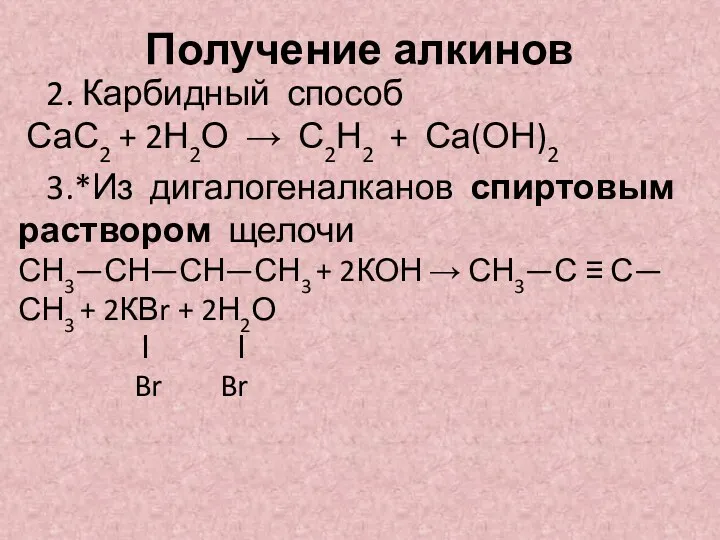
- 6. Получение алкинов 2. Карбидный способ СаС2 + 2Н2О → С2Н2 + Са(ОН)2 3.*Из дигалогеналканов спиртовым раствором
- 7. Физические свойства Ацетилен – газ легче воздуха, мало растворим в воде, в чистом виде почти без
- 8. Электрофильное присоединение Происходит в две стадии по месту расположения пи- связи (сначала разрушается одна пи-связь, образуется
- 9. Суммарное уравнение: CH ≡CH + 2Br₂→CHBr₂—CHBr₂ Качественная реакция на пи-связь обесцвечивание бромной воды.
- 10. Гидрирование Закончить уравнения реакций. 2. Присоединение водорода: СН ≡ СН + Н2 → Y 1 стадия:
- 11. Ответ для реакции гидрирования Присоединение водорода: СН ≡ СН + 2Н2 → CH₃—CH₃ 1 стадия: СН
- 12. Гидрогалогенирование Составить уравнение реакции 1 стадии присоединения хлороводорода. 3.присоединение галогеноводорода СН ≡ СН + НСl →
- 13. Ответ для реакции гидрогалогенирования СН ≡ СН + НСl → СН2= СНСl – винилхлорид Продукт первой
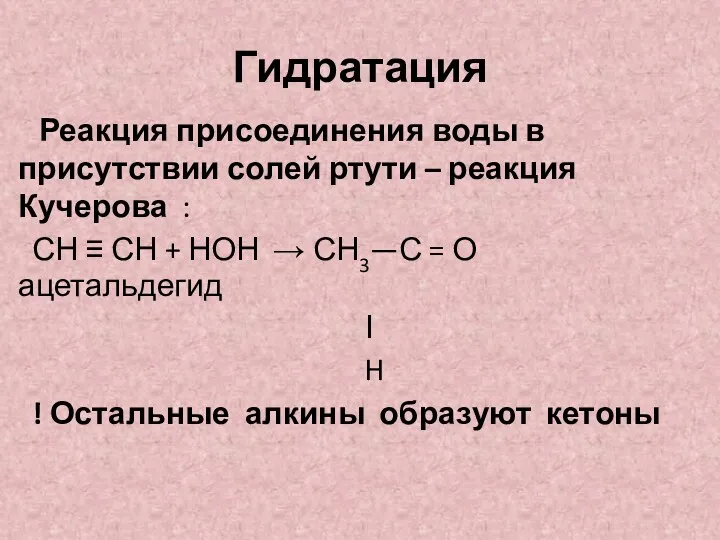
- 14. Гидратация Реакция присоединения воды в присутствии солей ртути – реакция Кучерова : СН ≡ СН +
- 15. Окисление 1. Горение(закончить уравнение реакции): С2Н2 + О2 → ? Ацетилен горит коптящим пламенем, т.к. соотношение
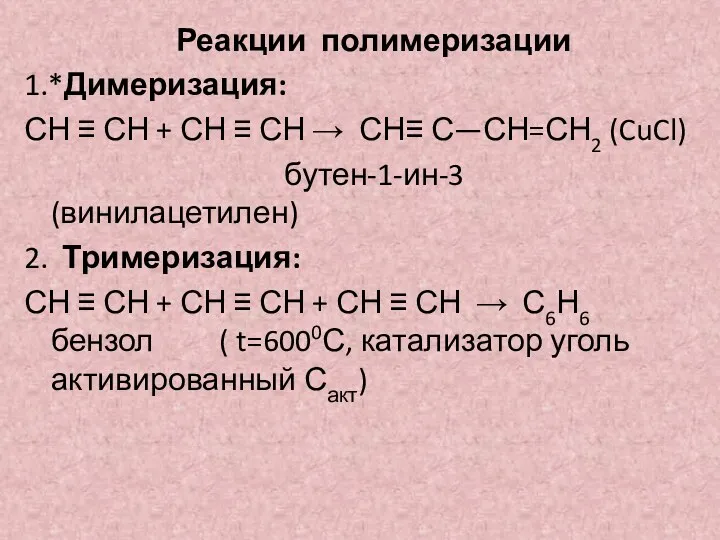
- 16. Реакции полимеризации 1.*Димеризация: СН ≡ СН + СН ≡ СН → СН≡ С—СН=СН2 (CuCl) бутен-1-ин-3 (винилацетилен)
- 17. Неоконченный текст Вещество с формулой C₂H₂ называется ¹ _ _ _ _ . Он является первым
- 18. Выполните задание 1 уровень Закончить уравнения реакций: 1. C₂H₂+Cl₂→ 2. C₃H₄+O₂→ 3. CH ≡ CH—CH₃+HBr→ 4.
- 20. Скачать презентацию













 Определение начал и концов
Определение начал и концов О компании Росатом
О компании Росатом внеклассное мероприятие Жизнь Школьного Дневника
внеклассное мероприятие Жизнь Школьного Дневника Дошкольный возраст 3-7 лет
Дошкольный возраст 3-7 лет Лесное товароведение. Классификация лесных товаров
Лесное товароведение. Классификация лесных товаров Цвета 2 класс
Цвета 2 класс класс Вред
класс Вред Копилочка АМО 3
Копилочка АМО 3 Работы детей
Работы детей Шаблон Фракталы-18
Шаблон Фракталы-18 Интеграция 1С:УНФ
Интеграция 1С:УНФ открытый урок географии
открытый урок географии Агропромышленный комплекс России
Агропромышленный комплекс России Топырақтағы органикалық заттар
Топырақтағы органикалық заттар Гемофилия. Наследственные коагулопатии
Гемофилия. Наследственные коагулопатии Лекция 2 проектирование АТК. Основы проектирования автоматизированных технологических комплексов
Лекция 2 проектирование АТК. Основы проектирования автоматизированных технологических комплексов Динамика жилищного строительства
Динамика жилищного строительства Почему кукушка подкидывает свои яйца в чужие гнезда
Почему кукушка подкидывает свои яйца в чужие гнезда Грамотная утилизация батареек
Грамотная утилизация батареек Переробка нафти
Переробка нафти К чему может привести знание свойств линейной функции. Учебный проект
К чему может привести знание свойств линейной функции. Учебный проект презентация
презентация Презентация Атлантический океан 7 класс
Презентация Атлантический океан 7 класс Презентация Одаренные дети
Презентация Одаренные дети Основы православной культуры. Традиции празднования Рождества Христова в России
Основы православной культуры. Традиции празднования Рождества Христова в России Корея Республикасы мен ҚР арасындағы келіссөздер мен іс-сапарларға байланысты дайындалатын дипломатиялық қүжаттар
Корея Республикасы мен ҚР арасындағы келіссөздер мен іс-сапарларға байланысты дайындалатын дипломатиялық қүжаттар Как научиться управлять классом
Как научиться управлять классом Крыши гражданских зданий
Крыши гражданских зданий