Содержание
- 2. VII A группа (галогены) F Cl Br I 9 2 VIIA 19 17 VIIA 35,5 80
- 3. VII A группа (галогены) F Cl Br I I II III IV V VI VII 1
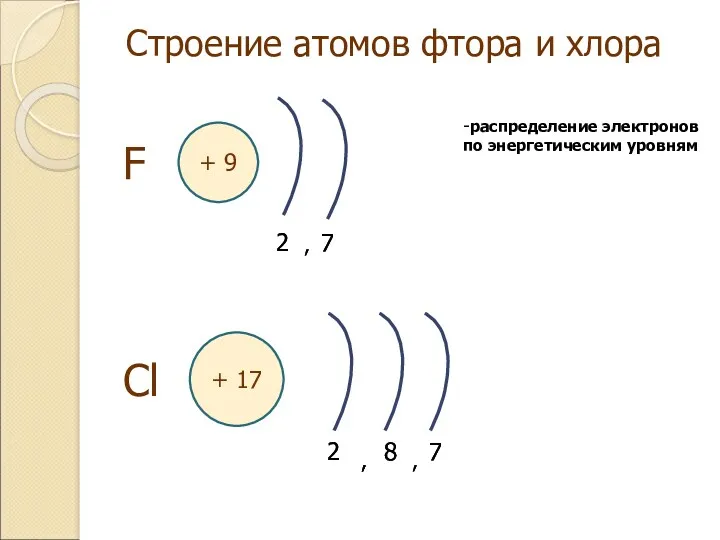
- 4. , Строение атомов фтора и хлора + 9 F 2 7 2 7 Cl + 17
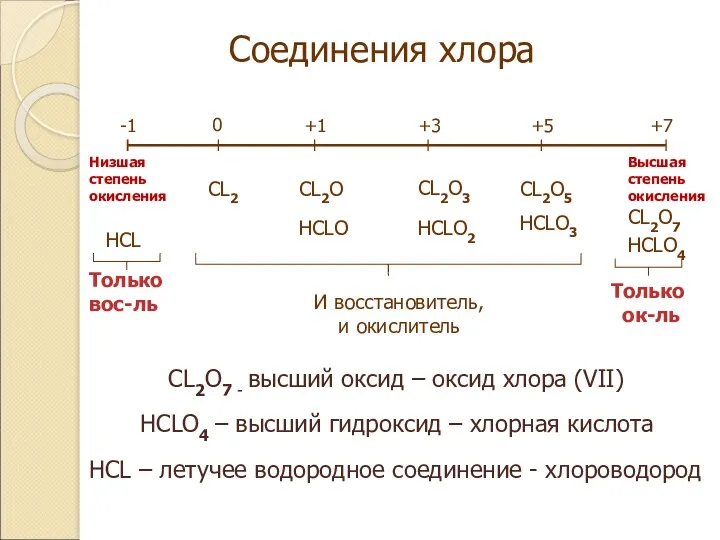
- 5. Соединения хлора -1 0 +1 +3 +5 +7 HCL CL2 CL2O HCLO CL2O3 HCLO2 CL2O5 HCLO3
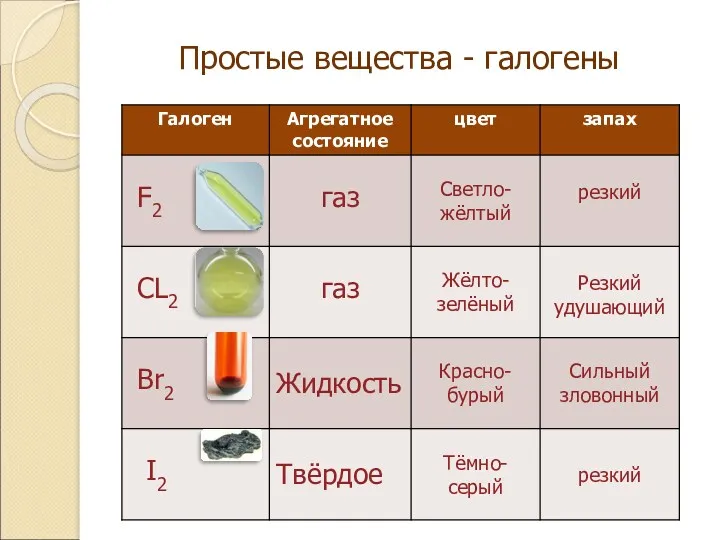
- 6. Простые вещества - галогены
- 7. Домашнее задание § 29 № 9.5; № 9.7; № 9.19* (Хомченко)
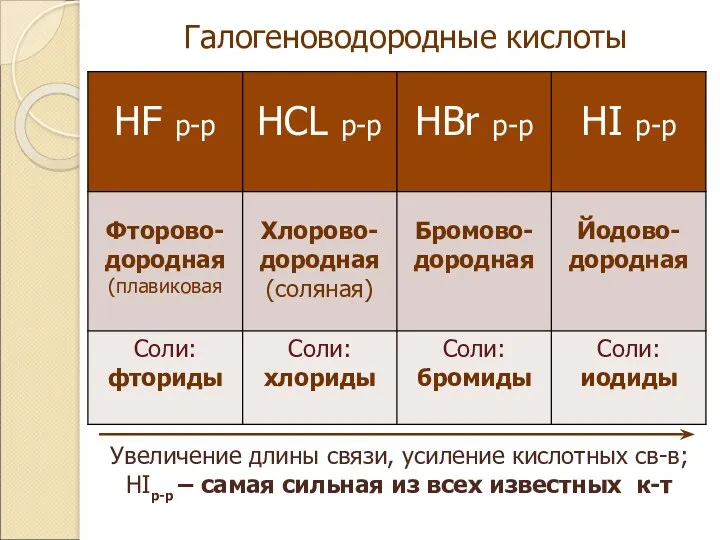
- 8. Галогеноводородные кислоты Увеличение длины связи, усиление кислотных св-в; HIр-р – самая сильная из всех известных к-т
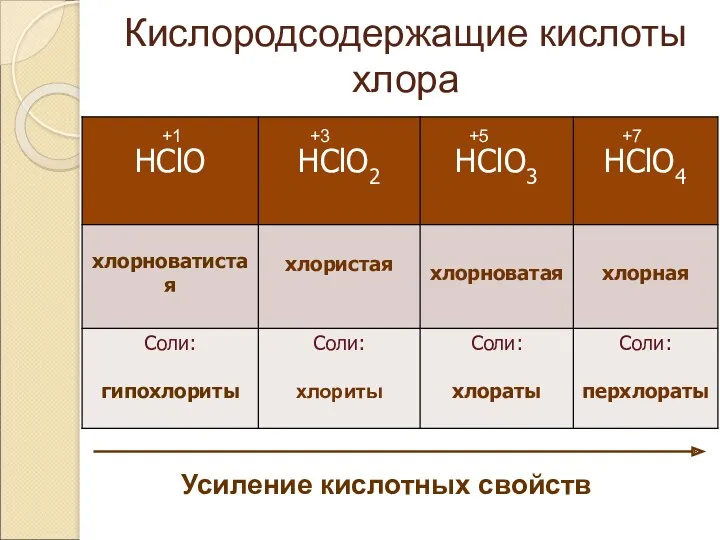
- 9. Кислородсодержащие кислоты хлора +1 +3 +5 +7 Усиление кислотных свойств
- 10. Химические свойства хлора 1. Взаимодействие с неметаллами: -é вос-ль +é ок-ль 2. Взаимодействие с металлами: -é
- 11. Химические свойства хлора 3. Взаимодействие с водой: 4. Взаимодействие с солями: Cl2 + H2O = HCl
- 12. 5. Взаимодействие сo щёлочами: Cl2 + 2NaOH = NaCl + NaClO + H2O хол. р-р 3Cl2
- 14. Скачать презентацию






 Презентация Театральная деятельность в детском саду, из опыта работы ГБОУ СОШ ж-д ст.Погрузная
Презентация Театральная деятельность в детском саду, из опыта работы ГБОУ СОШ ж-д ст.Погрузная Исламское право. Источники
Исламское право. Источники Урок ОРКСиЭ. Тема :Дружба
Урок ОРКСиЭ. Тема :Дружба Логопедический проект Моя удивительная буква
Логопедический проект Моя удивительная буква Логопедическая ритмика
Логопедическая ритмика Я великан. Игра
Я великан. Игра Силосы и бункеры
Силосы и бункеры 9 Мая
9 Мая Музеи в жизни города. 3 класс
Музеи в жизни города. 3 класс Гардеробная. Бланк замера
Гардеробная. Бланк замера Защита от антигенов. Иммунитет
Защита от антигенов. Иммунитет Окна Роста. Агитационные плакаты
Окна Роста. Агитационные плакаты Имидж педагога
Имидж педагога Родители как полноправные участники образовательных отношений в аспекте реализации основных образовательных программ
Родители как полноправные участники образовательных отношений в аспекте реализации основных образовательных программ Прощай, начальная школа. 4-б класс
Прощай, начальная школа. 4-б класс Первая полоса - лицо газеты
Первая полоса - лицо газеты Prezentatsia_Vlad_D-11
Prezentatsia_Vlad_D-11 Мои деды: участники ВОВ
Мои деды: участники ВОВ Презентация по теме Жидкие вещества
Презентация по теме Жидкие вещества Бароко: архітектура, скульпура, живопис
Бароко: архітектура, скульпура, живопис Взаимосвязь эмпатии личности и выбора стратегий поведения в конфликте (на примере общеобразовательной организации)
Взаимосвязь эмпатии личности и выбора стратегий поведения в конфликте (на примере общеобразовательной организации) Протон и нейтрон. Строение ядра
Протон и нейтрон. Строение ядра Развивающие игры палочки Кюизенера
Развивающие игры палочки Кюизенера Здоровый образ жизни
Здоровый образ жизни Конспект занятия по безопасности жизнедеятельности дошкольников с включением компьютерной игры На тему опасности дома (+ презентация)
Конспект занятия по безопасности жизнедеятельности дошкольников с включением компьютерной игры На тему опасности дома (+ презентация) Дисграфия и дислексия у учащихся начальных классов
Дисграфия и дислексия у учащихся начальных классов Петербургские музеи-хранители истории
Петербургские музеи-хранители истории Города и сельские поселения
Города и сельские поселения