Содержание
- 2. Открытие протона (1919 г. Резерфорд) «Протон» (греч.) – protos - первый Обозначение протона: или Протон –
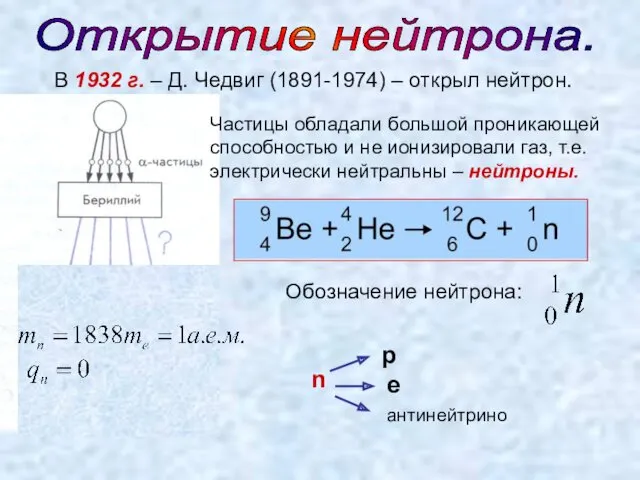
- 3. Открытие нейтрона. В 1932 г. – Д. Чедвиг (1891-1974) – открыл нейтрон. Частицы обладали большой проникающей
- 4. В 1932 г. Д.Д. Иваненко (рус.) и В. Гейзенберг (нем.) – предложили протонно-нейтронную модель ядра. Ядро
- 5. Ядерные силы Силы притяжения, связывающие протоны и нейтроны в атомном ядре, называются ядерными силами. Свойства: Являются
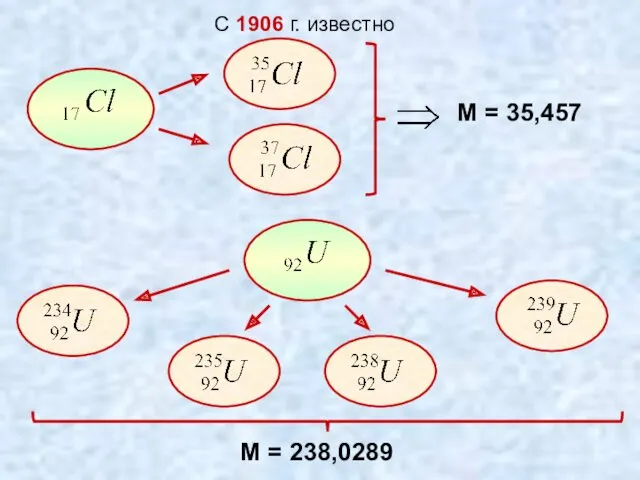
- 6. С 1906 г. известно М = 35,457 М = 238,0289
- 7. Изотопами называются разновидности данного химического элемента, различающиеся по массе их ядер. Изотоп «Изос» -одинаковый «Топос» -
- 8. 99,985% 0,015% Природный изотопный состав Н
- 9. 1). У всех химических элементов есть изотопы. 2). У изотопов одного элемента химические свойства одинаковы. 3).
- 10. Задача №1 Сколько нуклонов содержат ядра: Задача №2 Определите нуклоновый состав ядер: Задача №3 Назовите химический
- 12. Скачать презентацию







 Сюжетно - ролевая игра Банк
Сюжетно - ролевая игра Банк Викторина для детей
Викторина для детей Презентация по технологии Снежинка
Презентация по технологии Снежинка Проект Авто
Проект Авто Родительское собрание Переходный возраст подростка
Родительское собрание Переходный возраст подростка Теорема Менелая
Теорема Менелая Исскуство общения
Исскуство общения Отопление. Способы отопления зданий. Требования к отопительным установкам и системам
Отопление. Способы отопления зданий. Требования к отопительным установкам и системам Упаковочное оборудование для кондитерских изделий
Упаковочное оборудование для кондитерских изделий Психология общения с клиентами
Психология общения с клиентами Отқа төзімлді материалдар
Отқа төзімлді материалдар Презентация к классному часу Здоровый ребёнок в здоровой семье
Презентация к классному часу Здоровый ребёнок в здоровой семье Линейные электрические цепи постоянного тока. Лекция 1
Линейные электрические цепи постоянного тока. Лекция 1 Формы организации интерактивного обучения
Формы организации интерактивного обучения Проповедь Христа
Проповедь Христа Prezentatsia_Mikhedov
Prezentatsia_Mikhedov Презентация Взаимодействие с семьей в условиях введения ФГТ
Презентация Взаимодействие с семьей в условиях введения ФГТ Конструкционные материалы. Сплавы на основе железа
Конструкционные материалы. Сплавы на основе железа Курациялық науқастарға локальді статустық мінездеме беру
Курациялық науқастарға локальді статустық мінездеме беру Процесс общения: основные понятия
Процесс общения: основные понятия Презентация История возникновения автомобиля
Презентация История возникновения автомобиля Экзегетика - толкование писаний
Экзегетика - толкование писаний Технология строительства тоннелей горным способом в породах крепких и средней крепости
Технология строительства тоннелей горным способом в породах крепких и средней крепости Математика и малыши
Математика и малыши День открытых дверей для родителей будущих первоклассников.
День открытых дверей для родителей будущих первоклассников. Переход от традиционного общества к индустриальному
Переход от традиционного общества к индустриальному Технология 3 класс, техника квиллинга, Снежинка
Технология 3 класс, техника квиллинга, Снежинка Оформление детской площадки детского сада
Оформление детской площадки детского сада