Содержание
- 2. Получение гидроксида меди (II) I группа: CuCl2 + 2KOH = Cu(OH)2 + 2KCl 2 группа: CuBr2
- 3. ТЕМА УРОКА: «РЕАКЦИИ ИОННОГО ОБМЕНА»
- 4. ВЗАИМОДЕЙСТВИЕ РАСТВОРА ХЛОРИДА ЖЕЛЕЗА (III) С ГИДРОКСИДОМ НАТРИЯ
- 5. 1) ЗАПИСАТЬ УРАВНЕНИЕ РЕАКЦИИИ В МОЛЕКУЛЯРНОЙ ФОРМЕ FeCI3 + 3NaOH = Fe(OH)3 + 3 NaCI 2)
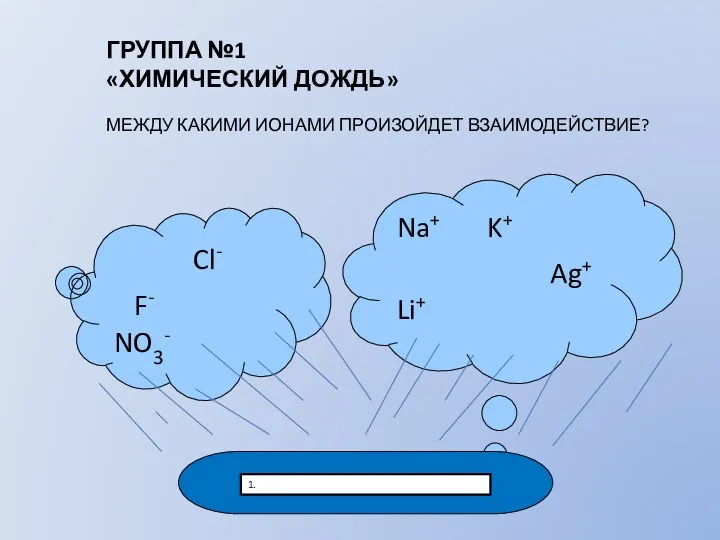
- 6. Cl- F- NO3- Na+ K+ Ag+ Li+ 1. ГРУППА №1 «ХИМИЧЕСКИЙ ДОЖДЬ» МЕЖДУ КАКИМИ ИОНАМИ ПРОИЗОЙДЕТ
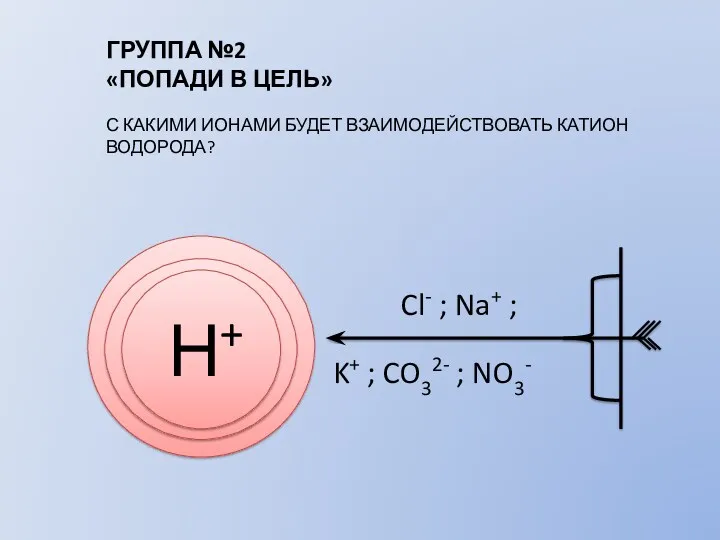
- 7. ГРУППА №2 «ПОПАДИ В ЦЕЛЬ» С КАКИМИ ИОНАМИ БУДЕТ ВЗАИМОДЕЙСТВОВАТЬ КАТИОН ВОДОРОДА? Н+ Cl- ; Na+
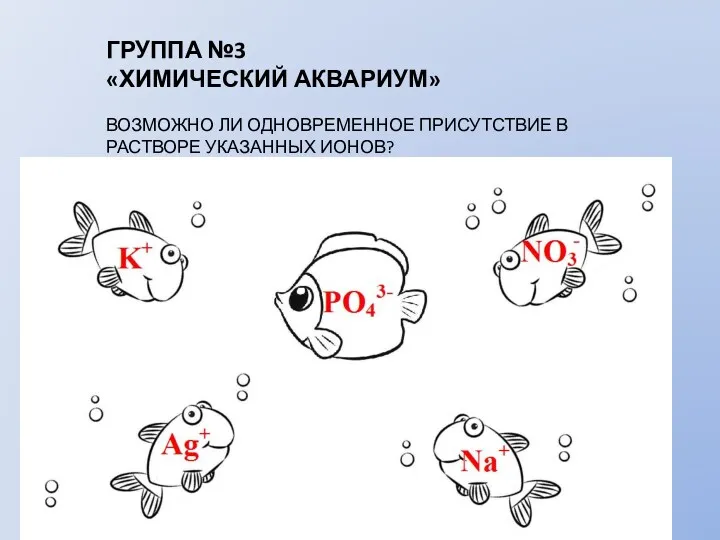
- 8. ГРУППА №3 «ХИМИЧЕСКИЙ АКВАРИУМ» ВОЗМОЖНО ЛИ ОДНОВРЕМЕННОЕ ПРИСУТСТВИЕ В РАСТВОРЕ УКАЗАННЫХ ИОНОВ?
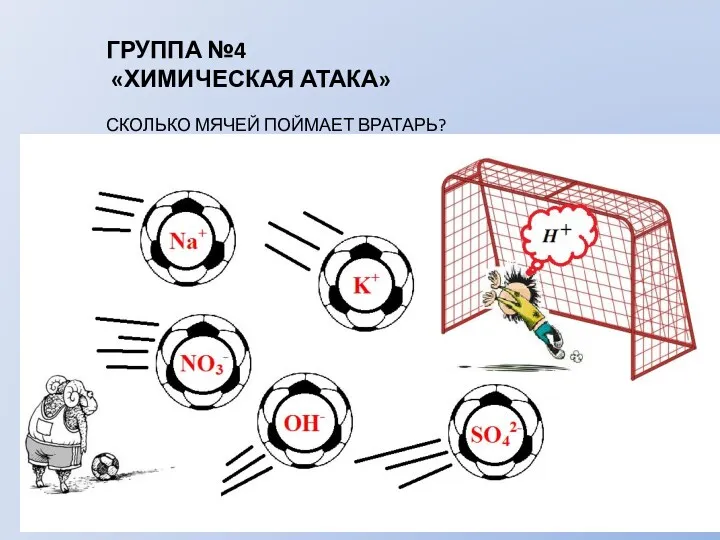
- 9. ГРУППА №4 «ХИМИЧЕСКАЯ АТАКА» СКОЛЬКО МЯЧЕЙ ПОЙМАЕТ ВРАТАРЬ?
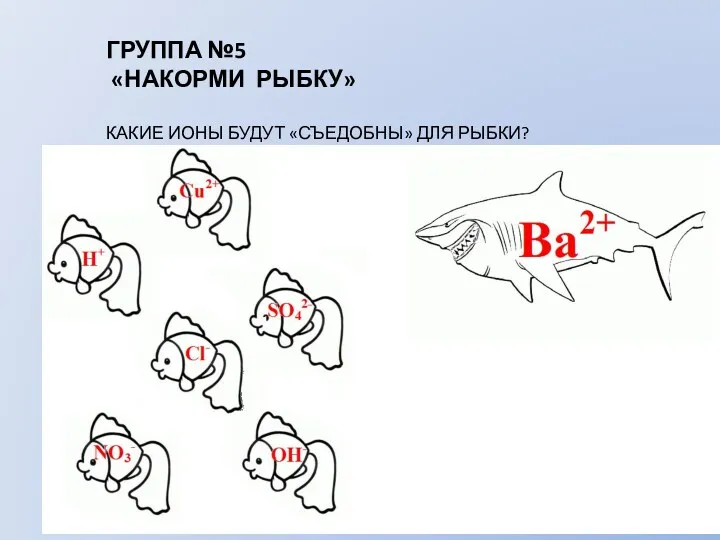
- 10. ГРУППА №5 «НАКОРМИ РЫБКУ» КАКИЕ ИОНЫ БУДУТ «СЪЕДОБНЫ» ДЛЯ РЫБКИ?
- 11. ПРИЗНАКИ НЕОБРАТИМОСТИ РЕАКЦИЙ ИОННОГО ОБМЕНА ОБРАЗОВАНИЕ ОСАДКА Cu 2++ 2OH- = Cu(OH)2 ОБРАЗОВАНИЕ ГАЗООБРАЗНОГО ВЕЩЕСТВА CO32-
- 12. Получение гидроксида меди (II) I группа: CuCl2 + 2KOH = Cu(OH)2 + 2KCl 2 группа: CuBr2
- 13. Краткое ионное уравнение получения гидроксида меди (II) из растворов солей меди Cu 2++ 2OH- = Cu(OH)2
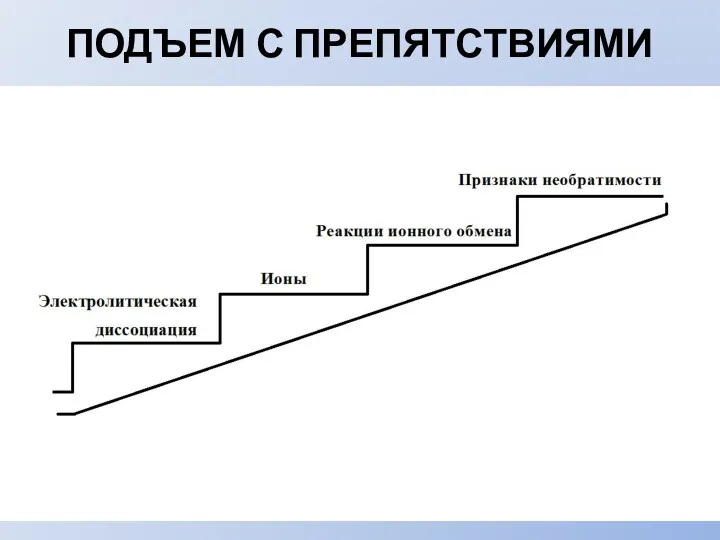
- 14. ПОДЪЕМ С ПРЕПЯТСТВИЯМИ
- 15. Самостоятельная работа
- 17. Скачать презентацию








 Animals
Animals Сущность и принципы общественных закупок
Сущность и принципы общественных закупок Гики как субкультура
Гики как субкультура Клинико-экономический подход к организации терапии ВИЧ-инфекции
Клинико-экономический подход к организации терапии ВИЧ-инфекции Мистецтво XIX ст
Мистецтво XIX ст Веселый этикет. Развитие коммуникативных способностей ребенка
Веселый этикет. Развитие коммуникативных способностей ребенка Формирование лексико-грамматических категорий у детей с билингвизмом
Формирование лексико-грамматических категорий у детей с билингвизмом формы организации учебной деятельности одарённых детей
формы организации учебной деятельности одарённых детей Энергосберегающие лампы
Энергосберегающие лампы Учимся определять грибы
Учимся определять грибы Поле чудес. Интерактивная игра по геометрии для учащихся 7 класса
Поле чудес. Интерактивная игра по геометрии для учащихся 7 класса Презентация Как работать над проектом
Презентация Как работать над проектом Сыры. Производство сыров
Сыры. Производство сыров Родительское собрание Как обеспечить духовную и психологическую безопасность подростка
Родительское собрание Как обеспечить духовную и психологическую безопасность подростка Владимиро-Суздальское княжество
Владимиро-Суздальское княжество Разработка системы управления макетом железной дороги
Разработка системы управления макетом железной дороги Шедевры музыкального искусства эпохи романтизма
Шедевры музыкального искусства эпохи романтизма Собрание по производственной практике для специальности ЭСБ
Собрание по производственной практике для специальности ЭСБ Влияние вредных факторов на плод
Влияние вредных факторов на плод Продолжение портфолио Новый год 2015 г.
Продолжение портфолио Новый год 2015 г. Исследования скважин и пластов
Исследования скважин и пластов Надзор и контроль за ОТ. Ответственность за нарушение НПА по ОТ
Надзор и контроль за ОТ. Ответственность за нарушение НПА по ОТ Зондирующий сигнал и его характеристики. Лекция №3. Часть 1. Теоретические основы радиолокации
Зондирующий сигнал и его характеристики. Лекция №3. Часть 1. Теоретические основы радиолокации ТРУБА ПРЕЗЕНТАЦИЯ
ТРУБА ПРЕЗЕНТАЦИЯ The olympics games
The olympics games Анестезия и интенсивная терапия в хирургии пищевода и в абдоминальной хирургии
Анестезия и интенсивная терапия в хирургии пищевода и в абдоминальной хирургии Презентация по органической химии Алкины
Презентация по органической химии Алкины Ғимараттарды қайтадан құру жобалау жұмыстарының технологиясы
Ғимараттарды қайтадан құру жобалау жұмыстарының технологиясы