Содержание
- 2. Лабораторный опыт 2 с.80 «Реакции ионного обмена в растворе»
- 3. Цель: . Осуществить практически реакции ионного обмена, выяснить условия протекания химических реакций между растворами электролитов до
- 4. Оборудование: пробирки, растворы хлорида железа (II), соляной кислоты, гидроксида натрия, хлорид натрия, нитрат калия, карбоната натрия,
- 5. Инструкция по технике безопасности: Запрещается использовать посуду, имеющую трещины и отбитые края.
- 6. Осторожно: кислоты и щёлочи – едкие вещества. Разрушают ткани, раздражают кожу, слизистые оболочки.
- 7. 3. После завершения работы тщательно помыть руки с мылом под проточной водой.
- 8. Первая помощь при порезах Обратиться к лаборанту или учителю (остановить кровотечение; кожу вокруг раны обработать йодной
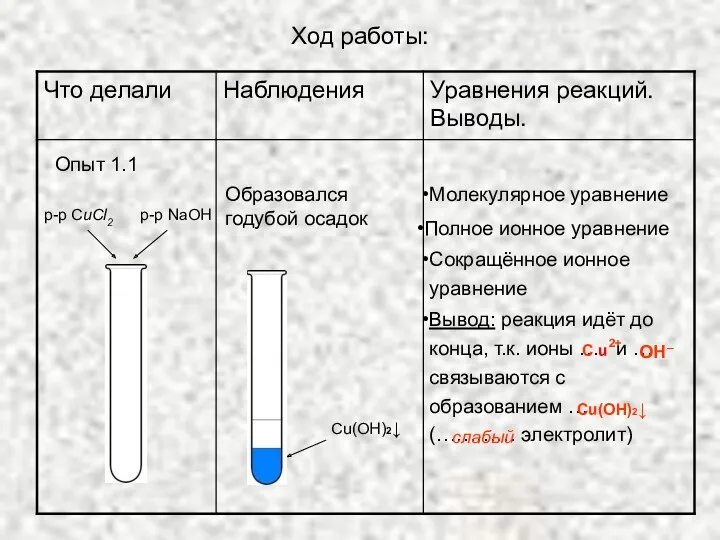
- 9. Ход работы: р-р СuCl2 р-р NaOH Cu(OH)2↓ Опыт 1.1 Образовался годубой осадок Молекулярное уравнение Полное ионное
- 10. Алгоритм составления молекулярного уравнения обмена 1.Обмениваю ( ! Н и О по любому – Н2 О)
- 11. Алгоритм составления ионно-молекулярного уравнения 1.Подчёркиваю нерастворимое или газообразное вещество, или воду 2.Электролиты делю на ионы (!
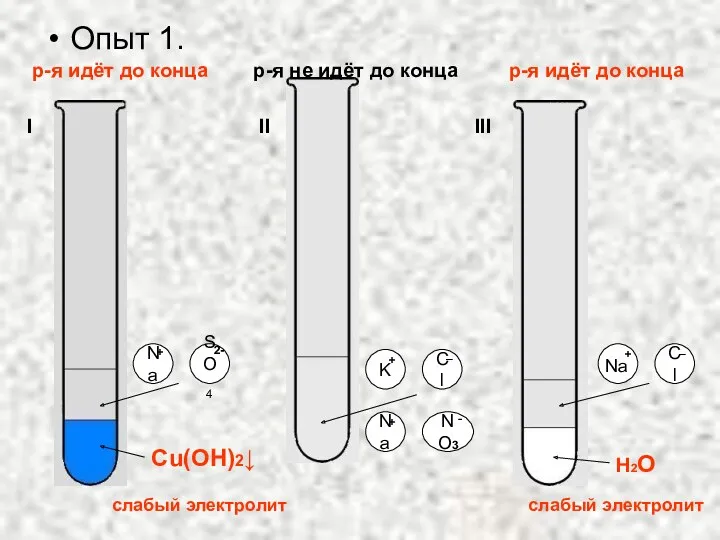
- 12. Опыт 1. Cu(OH)2↓ Na SO4 NO3 Na Cl K Cl 2- - H2O + + +
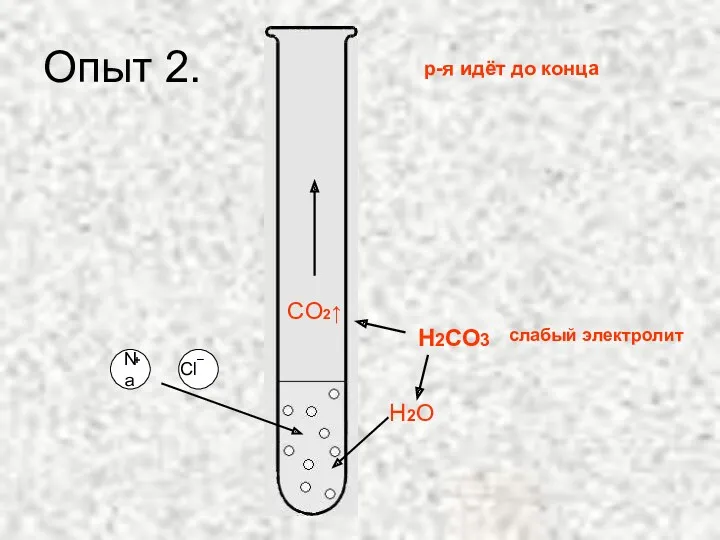
- 13. Опыт 2. CO2↑ Na Cl + _ H2O Н2СО3 р-я идёт до конца слабый электролит
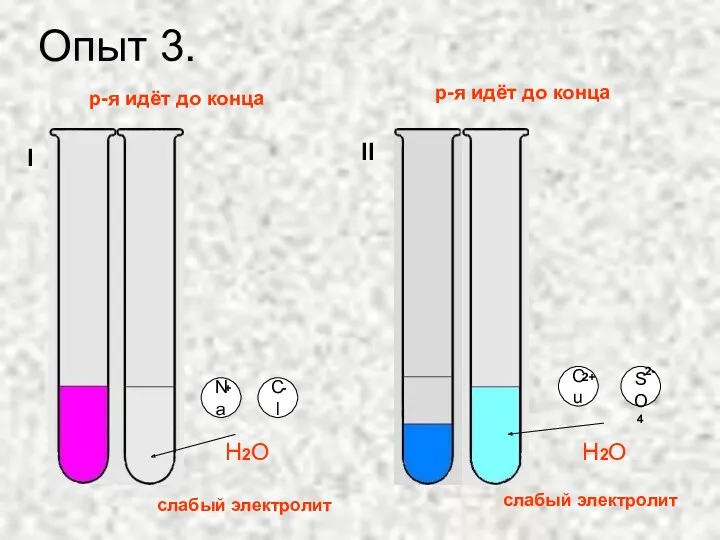
- 14. Опыт 3. Na SO4 Cu H2O H2O + 2+ 2- I II р-я идёт до конца
- 15. Вывод: Реакция ионного обмена протекает до конца при условии, что в растворе присутствуют ионы ………. электролита,
- 17. Скачать презентацию










 Рациональное питание
Рациональное питание Презентация История жеательной резинки
Презентация История жеательной резинки Правление Ивана IV Грозного (1533-1584)
Правление Ивана IV Грозного (1533-1584) Визитная карточка Д/С № 207
Визитная карточка Д/С № 207 Arduino. Проект: Beyond reason
Arduino. Проект: Beyond reason Спирты
Спирты Родительское собрание
Родительское собрание Большие социальные группы (Тема 4)
Большие социальные группы (Тема 4) Обобщенная структурная схема системы передачи дискретных сообщений (передачи данных)
Обобщенная структурная схема системы передачи дискретных сообщений (передачи данных) Мы делили апельсин. Пальчиковая гимнастика.
Мы делили апельсин. Пальчиковая гимнастика. Опыт проведения православного фестиваля детского художественного творчества Светлая Пасха
Опыт проведения православного фестиваля детского художественного творчества Светлая Пасха Эволюция звезд
Эволюция звезд Дүниежүзі елдерін даму деңгейі бойынша жіктеу
Дүниежүзі елдерін даму деңгейі бойынша жіктеу Правила школьной жизни
Правила школьной жизни Учет денежных средств в иностранной валюте
Учет денежных средств в иностранной валюте Возбуждение уголовного дела
Возбуждение уголовного дела О молитве
О молитве Улицы города Владимир, названные в честь владимирцев - героев Великой Отечественной Войны
Улицы города Владимир, названные в честь владимирцев - героев Великой Отечественной Войны Материал по краеведению Республики Адыгея
Материал по краеведению Республики Адыгея Теория и история потребительской кооперации
Теория и история потребительской кооперации Adding forces
Adding forces проект по теме: Дидактическая игра как средство развития словаря у детей младшего дошкольного возраста
проект по теме: Дидактическая игра как средство развития словаря у детей младшего дошкольного возраста Презентация к занятию Вежливость и доброта
Презентация к занятию Вежливость и доброта Общие положения об обязательствах
Общие положения об обязательствах СССР в годы перестройки
СССР в годы перестройки восприятие мира
восприятие мира Визитная карточка проекта НАШИ ПРЕЗЕНТАЦИИ.
Визитная карточка проекта НАШИ ПРЕЗЕНТАЦИИ. Опасности в Интернете
Опасности в Интернете