Содержание
- 2. Химические свойства серы S+Hg=HgS S+Cl2=SCl2 2S+C=CS2 2P+3S=P2S3 S+H2=H2S S+2Na=Na2S S+O2=SO2 S+3F2=SF6 ОКИСЛИТЕЛЬ ---S--- ВОССТАНОВИТЕЛЬ
- 3. Сероводород H2S Газообразное вещество с неприятным запахом тухлых яиц, тяжелее воздуха, Ядовит- разрушает гемоглобин крови, в
- 4. Химические свойства сероводорода Н2S+Br2=2HBr+S Более активный неметалл вытесняет серу )
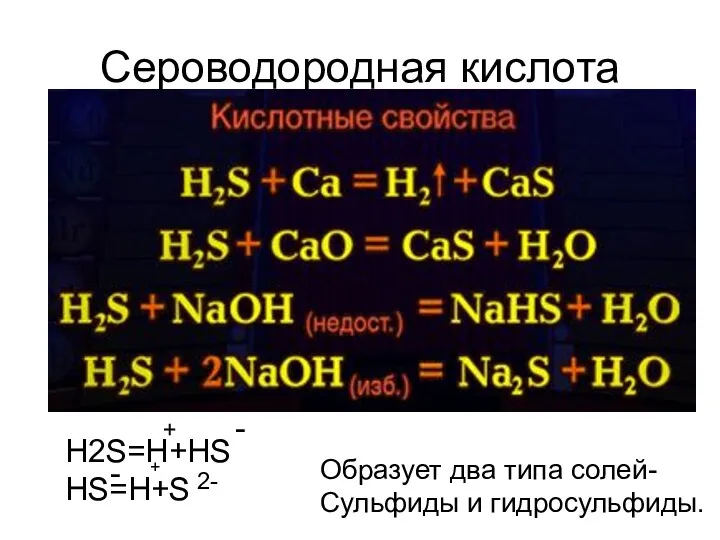
- 5. Сероводородная кислота H2S=H+HS HS=H+S + - + 2- - Образует два типа солей- Сульфиды и гидросульфиды.
- 6. Качественная реакция на сульфид-ион Pb(NO3)2+ H2S=PbS+2HNO3 ЧЁРНЫЙ ОСАДОК
- 7. Осуществите превращение 1)S ZnS H2S S задача Определить m H2S SO2 SO2,полученного при горении 16г S
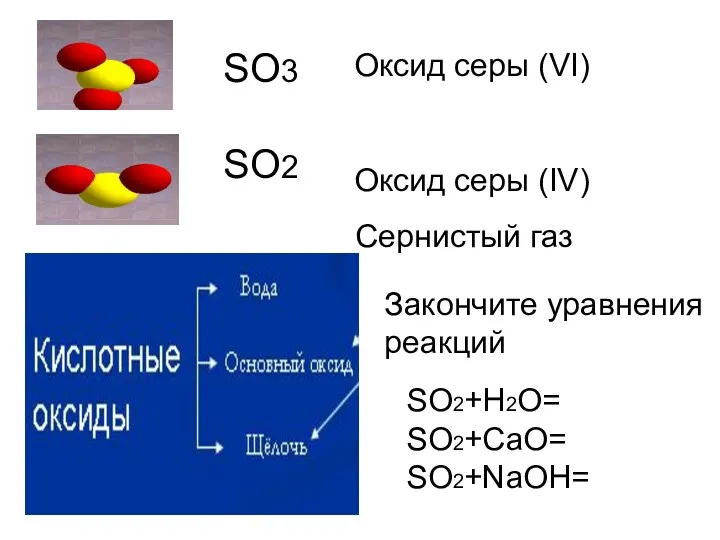
- 8. SO3 SO2 Оксид серы (VI) Оксид серы (IV) Сернистый газ SO2+H2O= SO2+CaO= SO2+NaOH= Закончите уравнения реакций
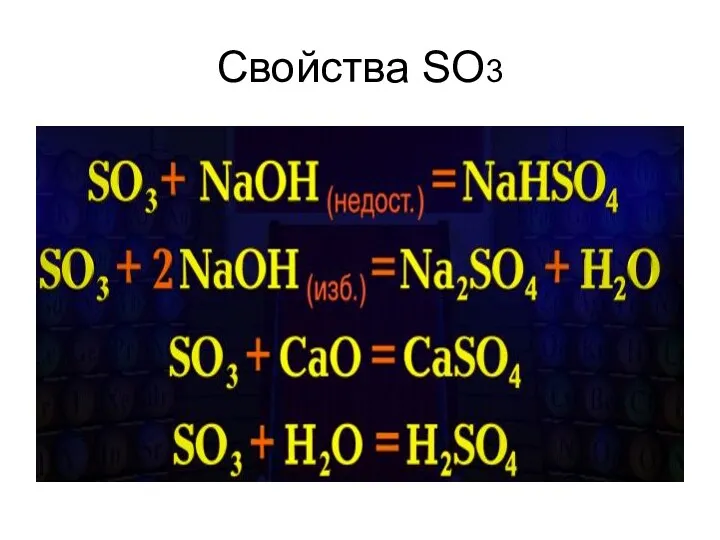
- 9. Свойства SO3
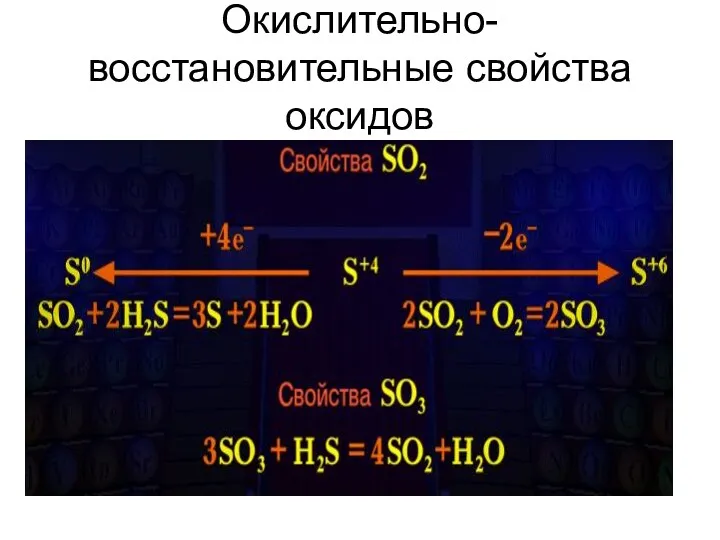
- 10. Окислительно-восстановительные свойства оксидов
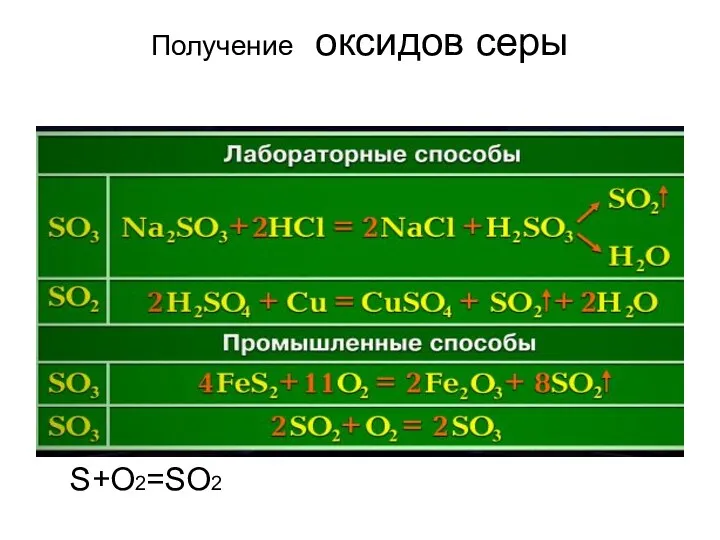
- 11. Получение оксидов серы S+O2=SO2
- 12. СЕРНАЯ КИСЛОТА H2SO4 (общие свойства кислот)
- 13. Взаимодействие с металлами Концентрированная серная кислота не реагирует с Au b Pt Пассивирует Fe, Cr? Al
- 14. Соли серной кислоты
- 16. Скачать презентацию








 Птица счастья. 2 класс
Птица счастья. 2 класс Ледники. Образование ледников
Ледники. Образование ледников Раздельный сбор мусора (1)
Раздельный сбор мусора (1) Методы стратегического управления образовательной организацией
Методы стратегического управления образовательной организацией Дидактический конструктор задач
Дидактический конструктор задач Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах
Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах Презентация М.В.Ломоносов
Презентация М.В.Ломоносов Проект Золотая осень
Проект Золотая осень Микропроцессоры. Структурная схема микропроцессорной системы
Микропроцессоры. Структурная схема микропроцессорной системы Объединение Великого Княжества Литовского и Польши в составе Речи Посполитой: причины, условия, итоги Люблинской унии
Объединение Великого Княжества Литовского и Польши в составе Речи Посполитой: причины, условия, итоги Люблинской унии Твердая фаза и поровое пространство почв. Плотность почвы
Твердая фаза и поровое пространство почв. Плотность почвы Сложи слова (для детей 5-7лет)
Сложи слова (для детей 5-7лет) Виды борьбы за существование
Виды борьбы за существование Бунин Иван Алексеевич. Деревня
Бунин Иван Алексеевич. Деревня Работа на мини конференциях в рамках урока географии
Работа на мини конференциях в рамках урока географии Информационные средства обучения географии
Информационные средства обучения географии Образовательная программа детского объединения Акварелька
Образовательная программа детского объединения Акварелька Международная энергоинновационная компания“ QUANTUM ELECTRIC”
Международная энергоинновационная компания“ QUANTUM ELECTRIC” Пожарная безопасность
Пожарная безопасность Токарно-винторезный станок 16К20
Токарно-винторезный станок 16К20 Системы обеспечения функционирования телекоммуникационных сетей. Занятие №14
Системы обеспечения функционирования телекоммуникационных сетей. Занятие №14 Вебинар Развивающая среда в ДОУ (презентация)
Вебинар Развивающая среда в ДОУ (презентация) Презентация Архангельск - Город Воинской Славы
Презентация Архангельск - Город Воинской Славы Океан Ельзи
Океан Ельзи
 Урок памяти Неизвестный солдат
Урок памяти Неизвестный солдат День Святой Троицы (Пятидесятница)
День Святой Троицы (Пятидесятница) Коза и овца.
Коза и овца.