Содержание
- 2. ОГЛАВЛЕНИЕ Скорость химической реакции. Скорость химической реакции. Энергия активации. Факторы, влияющие на скорость химической реакции: природа
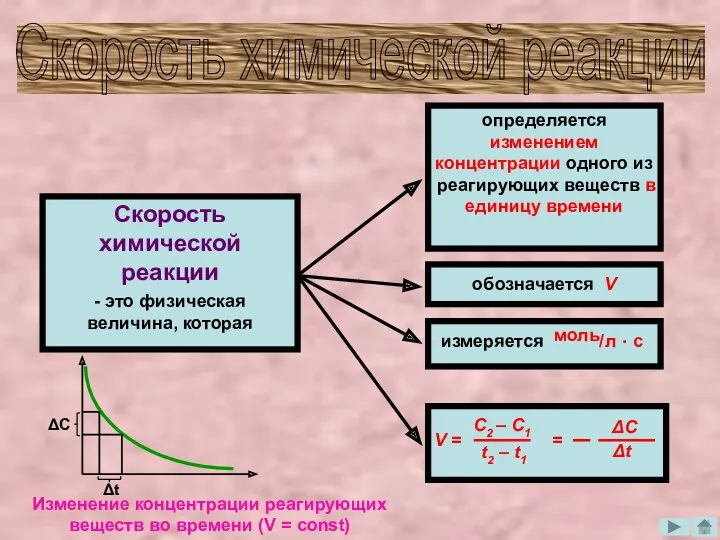
- 3. Скорость химической реакции Скорость химической реакции - это физическая величина, которая определяется изменением концентрации одного из
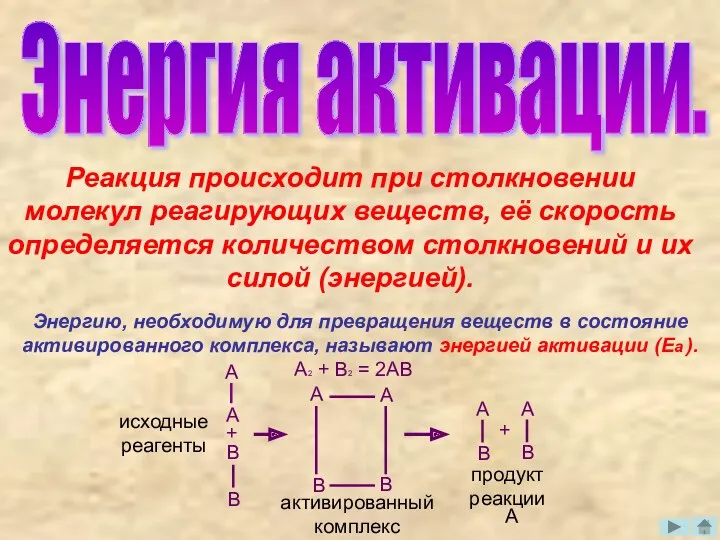
- 4. Энергия активации. Реакция происходит при столкновении молекул реагирующих веществ, её скорость определяется количеством столкновений и их
- 5. 2 Na + 2H2O = 2NaOH + H2 (всегда) Zn + H2O = ZnO + H2
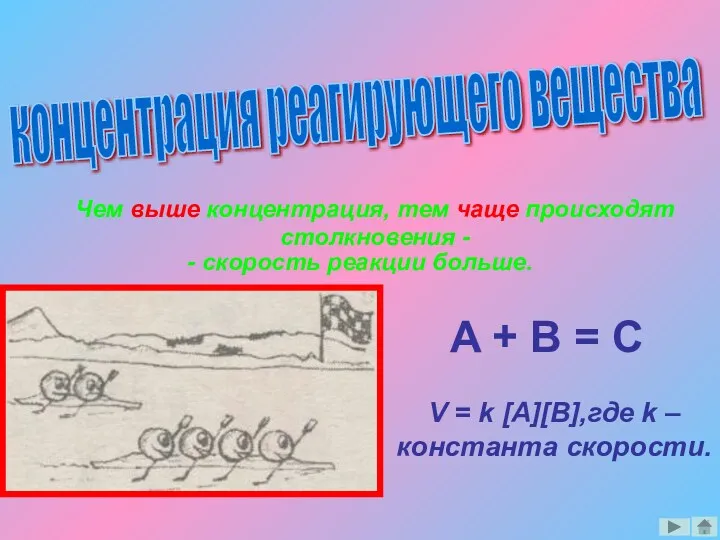
- 6. концентрация реагирующего вещества Чем выше концентрация, тем чаще происходят столкновения - - скорость реакции больше. A
- 7. Температура При повышении температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза (правило Вант-Гоффа).
- 8. Поверхность соприкосновения реагирующих веществ Для гетерогенных систем * скорость прямо пропорциональна поверхности соприкосновения реагирующих веществ. Твёрдое
- 10. Скачать презентацию




 Распределительный закон умножения
Распределительный закон умножения Последовательные и параллельные порты
Последовательные и параллельные порты Технология и схемотехника средств управления в технических системах
Технология и схемотехника средств управления в технических системах Проект Любимые игрушки
Проект Любимые игрушки Многоугольники ( урок 1). 5 класс
Многоугольники ( урок 1). 5 класс Воздушный транспорт
Воздушный транспорт Презентация Что такое ИКТ
Презентация Что такое ИКТ Типы экономических систем
Типы экономических систем Методическая подборка Ручные швы
Методическая подборка Ручные швы Проект Создание и исследование игрушки-вертушки и игрушки-балансира
Проект Создание и исследование игрушки-вертушки и игрушки-балансира Riddles
Riddles Портфолио. Организация видов работ при эксплуатации и реконструкции строительных объектов
Портфолио. Организация видов работ при эксплуатации и реконструкции строительных объектов Проблемы гражданскопатриотического воспитания ребёнка в семье
Проблемы гражданскопатриотического воспитания ребёнка в семье Пародонт ауруының профилактикасындағы ауыз қуысы гигиенасының рөлі
Пародонт ауруының профилактикасындағы ауыз қуысы гигиенасының рөлі Презентация Алюминий
Презентация Алюминий Радиопередающие и радиоприёмные устройства в системах радиосвязи
Радиопередающие и радиоприёмные устройства в системах радиосвязи Введение во храм Пресвятой Богородицы
Введение во храм Пресвятой Богородицы Происхождение башкирского народа
Происхождение башкирского народа Гимнастика для пальчиков Колобок
Гимнастика для пальчиков Колобок Конспект группового занятия на тему: Дифференциация согласных звуков С - Ш
Конспект группового занятия на тему: Дифференциация согласных звуков С - Ш Гелиоцентрическая система мира
Гелиоцентрическая система мира Юхимчук А.2161 Проблемное обуч
Юхимчук А.2161 Проблемное обуч Радиоэлектроника. Элемент питания
Радиоэлектроника. Элемент питания Нефть и продукты ее переработки
Нефть и продукты ее переработки Интерактивная физминутка Зарядка
Интерактивная физминутка Зарядка ВидеопрезентацияВзаимодействие учителя-логопеда и воспитателя
ВидеопрезентацияВзаимодействие учителя-логопеда и воспитателя Глобальное потепление. Причины, последствия. Влияние глобального потепления на климат Крыма на примере Симферопольского района
Глобальное потепление. Причины, последствия. Влияние глобального потепления на климат Крыма на примере Симферопольского района Театрализованное деятельность как одно из средств повышения коррекционной работы с детьми, имеющие нарушения речи
Театрализованное деятельность как одно из средств повышения коррекционной работы с детьми, имеющие нарушения речи