Содержание
- 2. Отходы 95 % Специальные полигоны. Несанкционированные свалки 5 % Мусоросжигательные и мусороперерабатывающие заводы Утилизация ТБО глобальная
- 3. Скорость химической реакции. Факторы влияющие на скорость химической реакции. Тема :
- 4. Проблема учебного занятия. Помогут ли решить проблему утилизации твердых бытовых отходов, знания о скорости химической реакции
- 5. Химические реакции Золотые украшения сохраняют свою красоту и блеск веками. Брошенный на улице старый автомобиль спустя
- 6. Что такое скорость? Скорость - это изменение какой-либо физической величины за единицу времени.
- 7. Какая величина, изменяется при протекании химической реакции? Концентрация вещества
- 8. это изменение концентрации одного из реагирующих веществ в единицу времени, в единицу объема. Скорость химической реакции
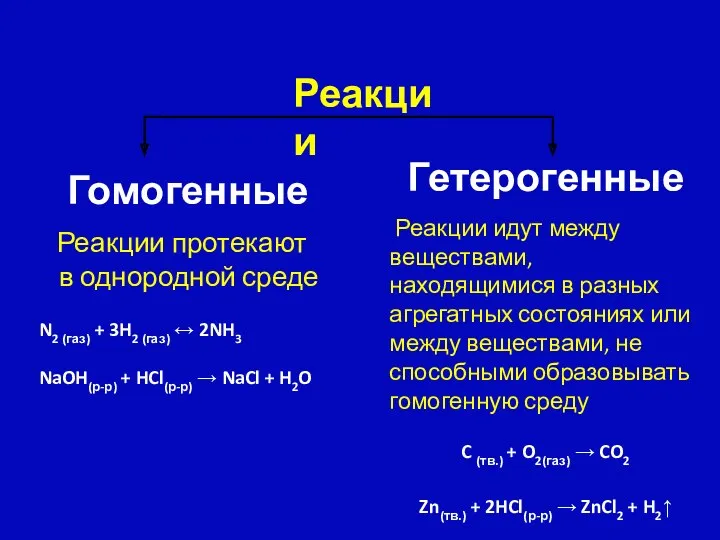
- 9. Реакции Гомогенные Реакции протекают в однородной среде N2 (газ) + 3H2 (газ) ↔ 2NH3 NaOH(р-р) +
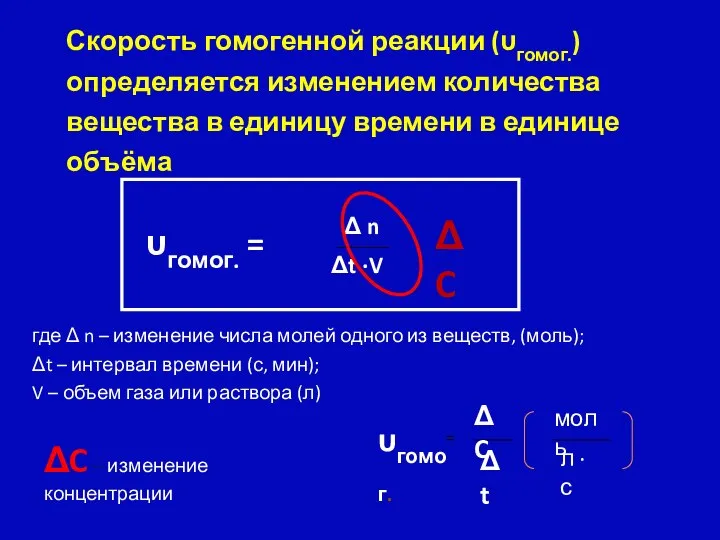
- 10. υгомог. = где Δ n – изменение числа молей одного из веществ, (моль); Δt – интервал
- 11. υгетер. Δt ∙ S Δ n = где Δ n – изменение количества вещества (реагента или
- 12. Почему реакций протекают с разной скоростью? Энергия активации Еакт - минимальный избыток энергии, который должна иметь
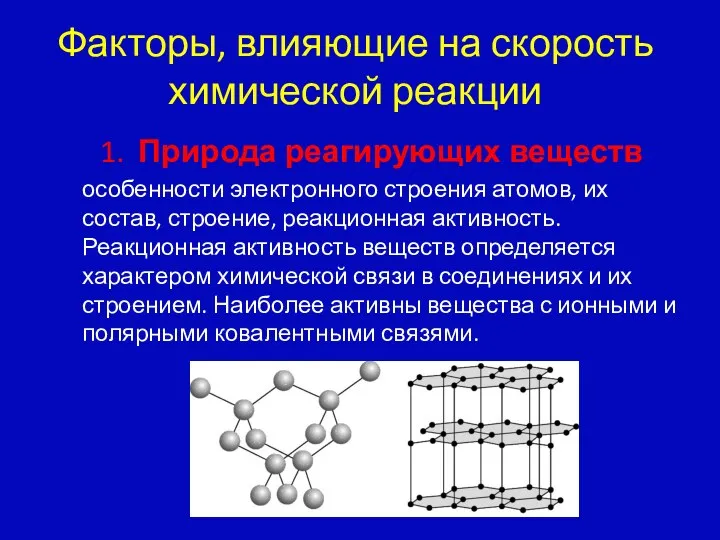
- 13. Факторы, влияющие на скорость химической реакции 1. Природа реагирующих веществ особенности электронного строения атомов, их состав,
- 14. 2. Температура. При повышении температуры на каждые 100 С, скорость реакции увеличивается в 2-4 раза. (правило
- 15. 3. Площадь соприкосновения реагирующих веществ Скорость реакции зависит от состояния поверхности соприкосновения реагирующих веществ. Чем больше
- 16. 4. Концентрация веществ. С повышением концентрации реагирующих веществ увеличивается скорость реакции. Закон действующих масс (з. д.
- 17. 5. Катализаторы и ингибиторы. Катализаторы – вещества, ускоряющие химические реакции. А + В → С –
- 18. Задача№ 1 В замкнутый сосуд вместимостью 5 литров помещены: водород массой 0,8 г и хлор. Через
- 19. Задача№2 Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘
- 20. Задача №3. Запишите кинетическое уравнение для следующих уравнений реакций: А) S(тв) + O2 (г) = SO2
- 21. В приготовление домашних соусов, используем уксусную кислоту, а не соляную или серную. Природа реагирующих веществ
- 22. Если нужно быстро истопить печь, мелко колем дрова. Площадь поверхности соприкосновения веществ
- 23. Что бы варенье не закисло, добавляем больше сахара. Концентрация реагирующих веществ Ингибитор
- 24. Что бы белье лучше отстирывалось используем теплую воду. Температура.
- 25. Скорость химической реакции в моей профессии.
- 26. Предложите способы ускорения разложения твердых бытовых отходов.
- 27. Сжигание. (применение фактора - температура) Выделяющуюся при этом тепловую энергию использовать в котельных, в системах отопления,
- 28. Измельчение (применение фактора –увеличение площади соприкосновения веществ)
- 29. Сортировка и переработка. (применение фактора природа реагирующих веществ) В Республике Мордовия немецкая компания «Ремондис» внедряет современную
- 30. Рефлексия Что вы изучили? Чему вы научились? Что вам понравилось?
- 31. Домашнее задание. Учебник Габриелян Химия. 11 класс § 15 с. 126-135 упр 7,10 с. 173 Вопросы
- 33. Скачать презентацию



























 Общение как взаимодействие и восприятие людьми друг друга
Общение как взаимодействие и восприятие людьми друг друга Распространение вируса иммунодефицита человека при оказании медицинской помощи
Распространение вируса иммунодефицита человека при оказании медицинской помощи Шаблон Фракталы-12
Шаблон Фракталы-12 Презентация творческой работы по теме: Сенсорное воспитание через развивающие игры
Презентация творческой работы по теме: Сенсорное воспитание через развивающие игры Презентация для родительского собрания Первые дни ребёнка в школе. Адаптация. 1 класс
Презентация для родительского собрания Первые дни ребёнка в школе. Адаптация. 1 класс Процессы и аппараты процессов нефтегазопереработки и нефтехимии
Процессы и аппараты процессов нефтегазопереработки и нефтехимии Характеристика історичної особи: Йоганн Гутенберг
Характеристика історичної особи: Йоганн Гутенберг Родительское собрание Мы стали на год старше (в конце учебного года)
Родительское собрание Мы стали на год старше (в конце учебного года) In the jungle
In the jungle Стерилизация и дезинфекция. Современные системы экспрессконтроля стерилизации и дезинфекции
Стерилизация и дезинфекция. Современные системы экспрессконтроля стерилизации и дезинфекции Наука и научное познание. Понятия: профессиональное, учебное, психолого-педагогическое исследование
Наука и научное познание. Понятия: профессиональное, учебное, психолого-педагогическое исследование Н.Н.Носов Затейники
Н.Н.Носов Затейники Сценарий развлечения КВН С днем рождения,Воркута
Сценарий развлечения КВН С днем рождения,Воркута Требования для промоутеров рекламного агентства Malina
Требования для промоутеров рекламного агентства Malina Структурное программирование: следование, ветвление, циклы
Структурное программирование: следование, ветвление, циклы Измерение площади
Измерение площади Подготовка ППЭ к проведению ГИА-11
Подготовка ППЭ к проведению ГИА-11 Игровое обучение в отечественной педагогической практике (на примере дошкольного образования)
Игровое обучение в отечественной педагогической практике (на примере дошкольного образования) Основы цифровой обработки сигналов (DSP)
Основы цифровой обработки сигналов (DSP) Основные этапы накопления знаний о Земле
Основные этапы накопления знаний о Земле 8 Марта
8 Марта Хронология культуры. Палеолит
Хронология культуры. Палеолит Бульдозерное отвалообразование
Бульдозерное отвалообразование Аварийные химические отравляющие вещества (АХОВ). Способы помощи при АОХВ. 4 лекция
Аварийные химические отравляющие вещества (АХОВ). Способы помощи при АОХВ. 4 лекция Учет аэродинамического сопротивления котла-утилизатора, расчет камеры дожигания
Учет аэродинамического сопротивления котла-утилизатора, расчет камеры дожигания Поведение человека – проявление его психики
Поведение человека – проявление его психики Презентация к мероприятию Инсценированная военная песня: песня Катюша.
Презентация к мероприятию Инсценированная военная песня: песня Катюша. Особенности обеспечения и контроля качества авиаГСМ по требованиям ИАТА. 6 лекция. Контроль качества ИАТА
Особенности обеспечения и контроля качества авиаГСМ по требованиям ИАТА. 6 лекция. Контроль качества ИАТА