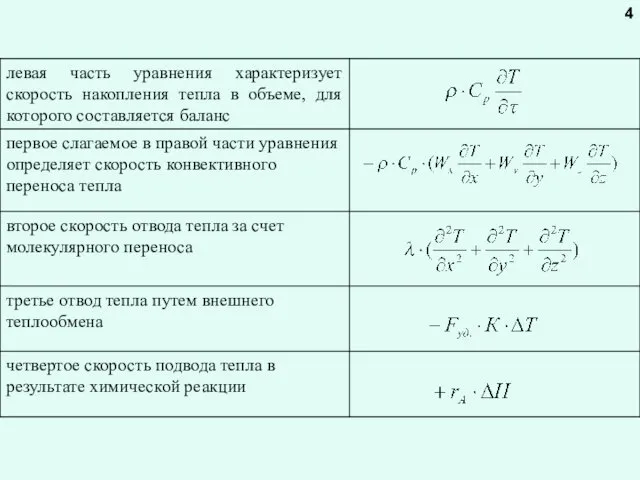
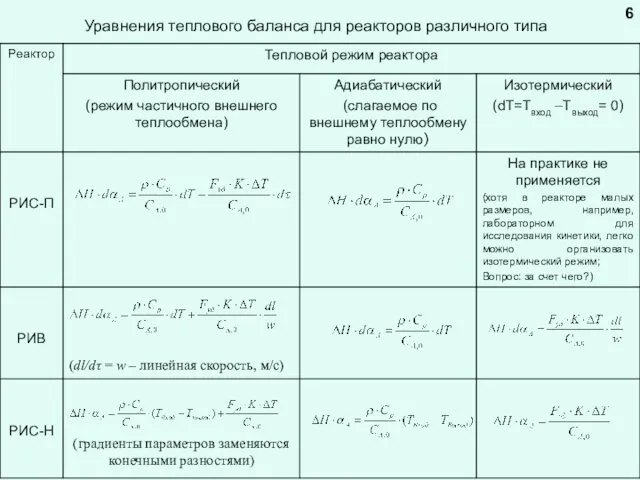
Уравнение теплового баланса реактора
Уравнение теплового баланса в общем виде
Qприход =
Qрасход,
где Qприход – количество тепла, поступающего в реактор в единицу времени,
Qрасход – количество тепла, расходуемого в реакторе в единицу времени.
Для экзотермической реакции тепло приходит в реактор с реагентами (Qсырье) и выделяется в результате химической реакции (Qхим.р.), соответственно:
Qприход = Qсырье + Qхим.р.
Расход тепла происходит в результате уноса тепла с продуктами (Qпрод.), теплообмена с окружающей средой (Qт/об.), а также «накапливается» в реакторе
(Qнакоп.), соответственно:
Qрасход = Qпрод. + Qт/об. + Qнакоп.
Исходя из равенства Qприход = Qрасход получаем:
Qнакоп. = Qсырье - Qпрод.- Qт/об. + Qхим.р.
или
Qнакоп. = - Qконв. - Qт/об. + Qхим.р.
где
Qконв. = Qпрод.- Qсырье – это количество тела, выносимого из реактора конвективным потоком
2








 Тактика следственного эксперимента
Тактика следственного эксперимента Северное сияние
Северное сияние Dogs
Dogs Анализ анекдотов на тему здравоохранения
Анализ анекдотов на тему здравоохранения Мотивационные теории
Мотивационные теории Турнир знатоков для 8 – 9 классов
Турнир знатоков для 8 – 9 классов Задания по сольфеджио и слушанию музыки для 1 класса
Задания по сольфеджио и слушанию музыки для 1 класса Дизайн-мышление (20)
Дизайн-мышление (20) Педагогический проект Нестандартные задачи как средство развития математического мышления и творческих способностей учащихс
Педагогический проект Нестандартные задачи как средство развития математического мышления и творческих способностей учащихс Презентация О воде и в шутку, и серьезно
Презентация О воде и в шутку, и серьезно Законодательная база в области защиты интеллектуальной собственности
Законодательная база в области защиты интеллектуальной собственности Стихи о дорожных знаках.
Стихи о дорожных знаках. Африка на перепутье
Африка на перепутье Радиостанции малой мощности. Командно-штабные машины. Переносные радиостанции УКВ диапазона (Тема 6.2)
Радиостанции малой мощности. Командно-штабные машины. Переносные радиостанции УКВ диапазона (Тема 6.2) Мотив волшебства в сказке Э.А.Т. Гофмана Щелкунчик и Мышиный король
Мотив волшебства в сказке Э.А.Т. Гофмана Щелкунчик и Мышиный король Конспект фронтальной ООД в подготовительной к школе группе (ОНР) . Тема: Звуки П, Пь. Буква П.
Конспект фронтальной ООД в подготовительной к школе группе (ОНР) . Тема: Звуки П, Пь. Буква П. Things to do
Things to do Организация данных на жестком диске компьютера
Организация данных на жестком диске компьютера Обработка металлов. Ковка
Обработка металлов. Ковка Цивилизации Запада и Востока в Средние века. Варварские государства. Раннее средневековье в Европе
Цивилизации Запада и Востока в Средние века. Варварские государства. Раннее средневековье в Европе Рисующий свет
Рисующий свет Энергосбережение
Энергосбережение Помощь воспитателям при изучении ФГОС
Помощь воспитателям при изучении ФГОС Тепловая электростанция (ТЭС)
Тепловая электростанция (ТЭС) Презентация по психологии Особенности общения младенца со взрослыми
Презентация по психологии Особенности общения младенца со взрослыми Презентация Орудия первобытного человека
Презентация Орудия первобытного человека ПОРТФОЛИО учителя начальных классов Орловой Натальи Александровны
ПОРТФОЛИО учителя начальных классов Орловой Натальи Александровны Наиболее острые проблемы промышленного развития и инвестиционной деятельности в г. Костроме
Наиболее острые проблемы промышленного развития и инвестиционной деятельности в г. Костроме