Содержание
- 2. Содержание 1.Определение 2.Номенклатура алкенов 3.Строение алкенов 4. Изомерия алкенов 5.Физические свойства 6.Химические свойства 7.Получение алкенов 8.Применение
- 3. Определение Алкены или олефины, или этиленовые углеводороды – непредельные углеводороды, в молекулах которых между атомами углерода
- 4. Номенклатура алкенов Название алкенов по систематической номенклатуре образуют из названий аналогично построенных алканов, заменяя суффиксы –ан
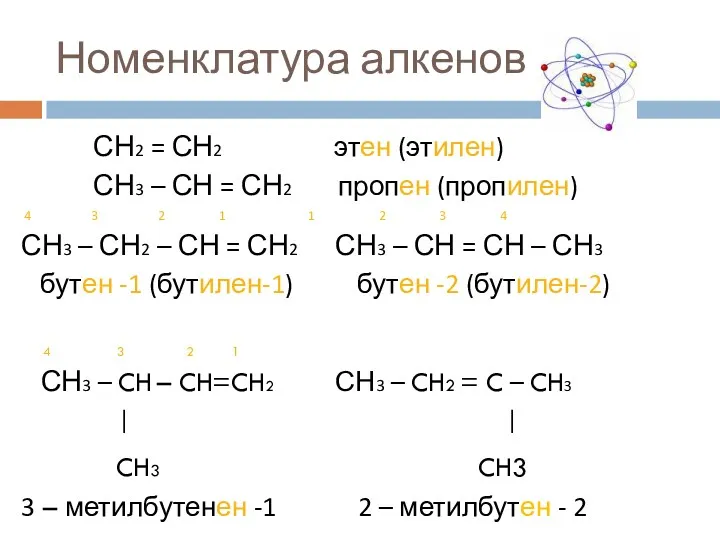
- 5. Номенклатура алкенов СН2 = СН2 этен (этилен) СН3 – СН = СН2 пропен (пропилен) 4 3
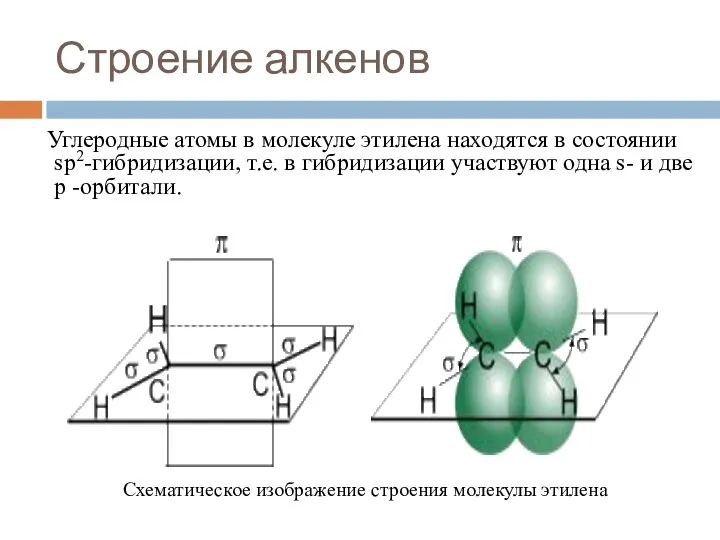
- 6. Строение алкенов Углеродные атомы в молекуле этилена находятся в состоянии sp2-гибридизации, т.е. в гибридизации участвуют одна
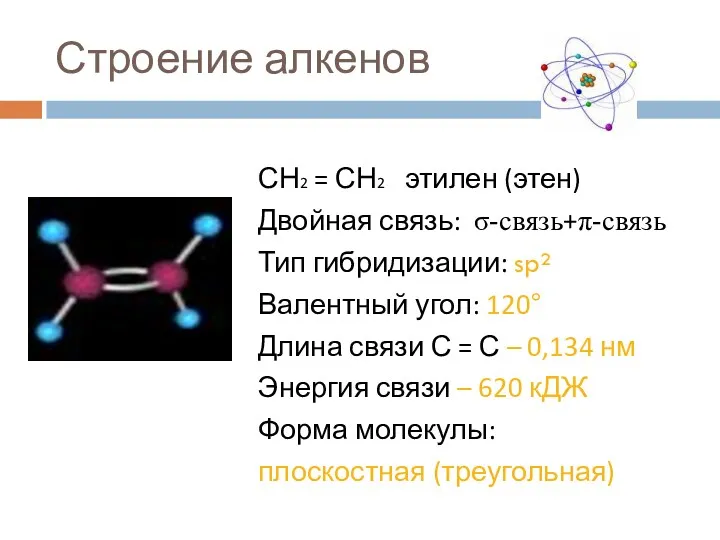
- 7. Строение алкенов СН2 = СН2 этилен (этен) Двойная связь: σ-связь+π-связь Тип гибридизации: sp² Валентный угол: 120°
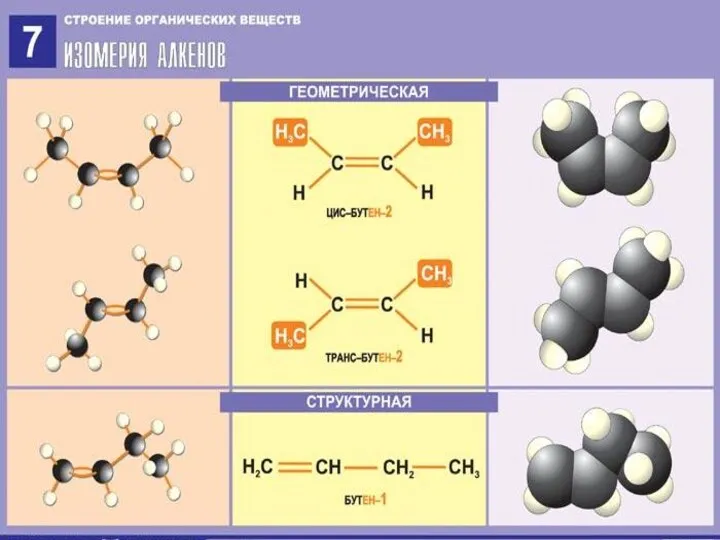
- 8. Изомерия алкенов Структурная изомерия 1) углеродного скелета CH2 = CH – CH2 – CH3 CH2 =
- 9. Изомерия алкенов Пространственная (геометрическая) CH3 H H H \ / \ / C = C C
- 10. Изомерия алкенов
- 11. Физические свойства По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4 –
- 12. Химические свойства I.Реакции присоединения: 1.Гидрирование : CH2=CH-CH3+Н2 → CH3-CH2-CH3 2.Галогенирование: CH2=CH-CH3+Br2 → CH2Br-CHBr -CH3 - обесцвечивание
- 13. Химические свойства 3.Гидрогалогенирование. Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом
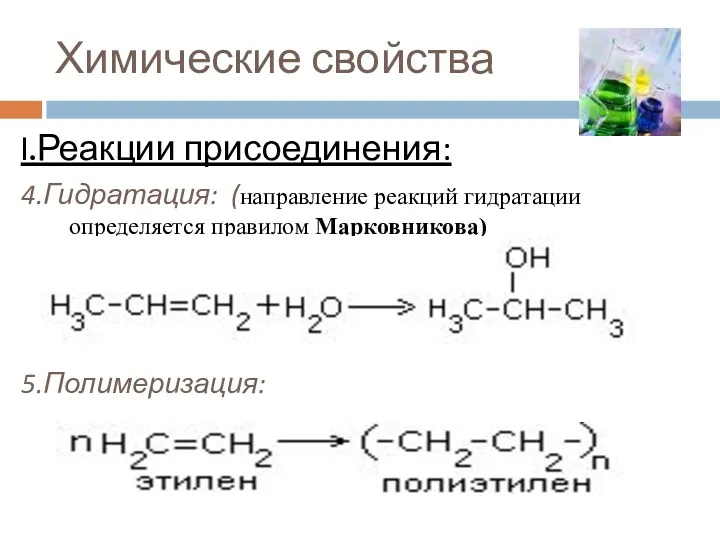
- 14. Химические свойства I.Реакции присоединения: 4.Гидратация: (направление реакций гидратации определяется правилом Марковникова) 5.Полимеризация:
- 15. Химические свойства II.Реакции окисления: 1.Полное окисление (горение): С2Н4 + 3О2 → 2СО2 + 2Н2О 2.Неполное окисление:
- 16. Химические свойства При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера).
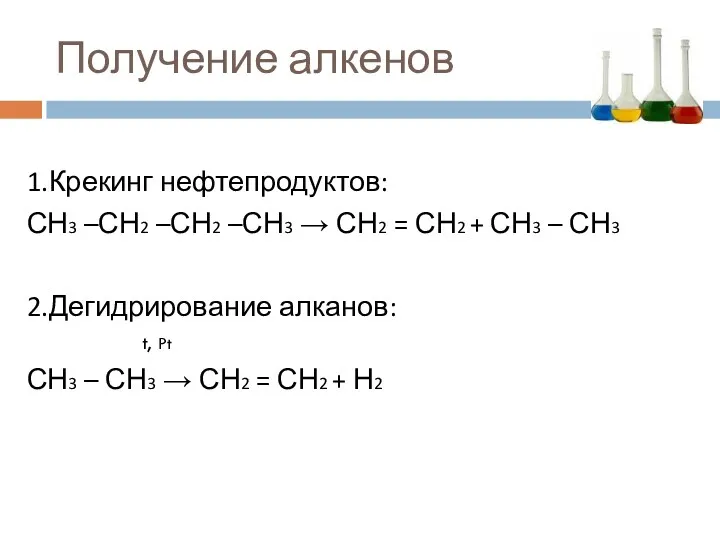
- 17. Получение алкенов 1.Крекинг нефтепродуктов: СН3 –СН2 –СН2 –СН3 → СН2 = СН2 + СН3 – СН3
- 18. Получение алкенов 3.Дегидратация спиртов: Порядок дегидратации вторичных и третичных спиртов определяется правилом А.М.Зайцева: при образовании воды
- 19. Получение алкенов (отщепление двух атомов галогена от соседних атомов углерода) при нагревании дигалогенидов с активными металлами)
- 20. Применение алкенов Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан,
- 21. Применение алкенов
- 23. Скачать презентацию














 История развития экологии как науки
История развития экологии как науки Призентация приложения к программе Доброморье
Призентация приложения к программе Доброморье Повышение эффективности ТЭУ
Повышение эффективности ТЭУ I wish a had a magic vacuum cleaner, instead of my old broom!
I wish a had a magic vacuum cleaner, instead of my old broom! Приложение 1 к уроку по теме Озёра. Презентация. часть 3
Приложение 1 к уроку по теме Озёра. Презентация. часть 3 Интегративный подход к организации развивающих центров активности детей
Интегративный подход к организации развивающих центров активности детей Интерактивная игра Своя игра. ОРКСЭ. Основы православной культуры.
Интерактивная игра Своя игра. ОРКСЭ. Основы православной культуры. Ливонская война
Ливонская война Концептуальные аспекты управления инновациями
Концептуальные аспекты управления инновациями История русской вышивки. Вышивка крестом
История русской вышивки. Вышивка крестом Геодезическое обеспечение геологоразведочных работ
Геодезическое обеспечение геологоразведочных работ Консультация для родителей второклассников.
Консультация для родителей второклассников. Поздравления с 8 марта
Поздравления с 8 марта Исследовательская работа: Прекрасные и опасные комнатные растения
Исследовательская работа: Прекрасные и опасные комнатные растения Усилители СВЧ
Усилители СВЧ SWOT-анализ
SWOT-анализ Западно-Сибирская низменность
Западно-Сибирская низменность Политическая карта мира
Политическая карта мира Педагогическая академия последипломного образования
Педагогическая академия последипломного образования Презентация кружка Уроки здоровья
Презентация кружка Уроки здоровья Многолучевые и сканирующие антенны. (Лекция 14)
Многолучевые и сканирующие антенны. (Лекция 14) Голландское искусство XVII в
Голландское искусство XVII в правила пожарной безопасности
правила пожарной безопасности Кислородные соединения углерода Диск
Кислородные соединения углерода Диск Метрологическое оборудование от калибратора до лаборатории
Метрологическое оборудование от калибратора до лаборатории Отморожения. Классификация
Отморожения. Классификация Последние дни земной жизни Господа нашего Иисуса Христа. Вход Господень в Иерусалим
Последние дни земной жизни Господа нашего Иисуса Христа. Вход Господень в Иерусалим Принтерлермен жұмыс істеу
Принтерлермен жұмыс істеу