Содержание
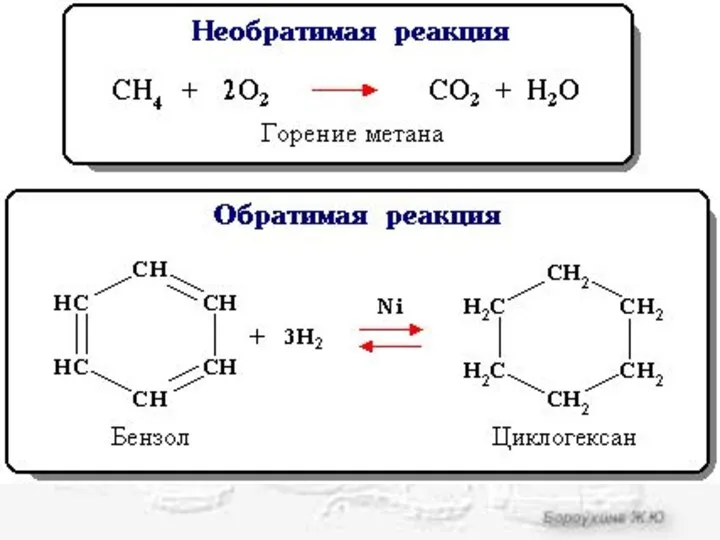
- 2. Химическое равновесие Состояние равновесия характерно для обратимых химических реакций. Обратимая реакция - химическая реакция, которая при
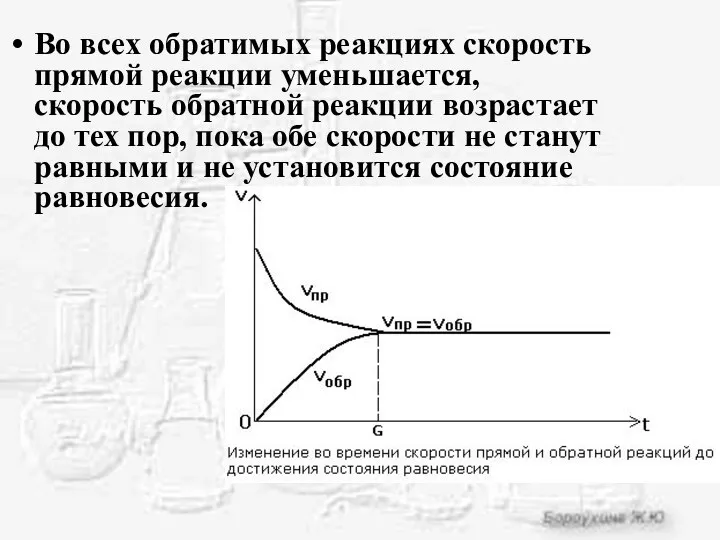
- 4. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока
- 5. Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
- 6. Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны. Химическое равновесие имеет динамический характер. Это значит,
- 7. Смещение равновесия в нужном направлении достигается изменением условий реакции (принцип Ле-Шателье). Принцип Ле-Шателье -Если на систему,находящуюся
- 8. Для одностадийной обратимой реакции при равновесии выражения для скоростей прямой V1 и обратной реакций V2 имеют
- 9. Из условия равновесия V1=V2 следует: Отсюда получаем выражение для константы равновесия Kp: Чем выше величина Kp,
- 10. Влияние температуры на смещение равновесия Реакции, сопровождающиеся выделением теплоты, называются экзотермическими. Реакции, сопровождающиеся поглощением теплоты, называются
- 11. Влияние температуры на смещение равновесия Чтобы сместить равновесие вправо (для экзотермической реакции)---нужно понизить температуру. А для
- 12. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении
- 13. Влияние концентрации на смещение равновесия Равновесие сместится ВПРАВО, если: Увеличить концентрацию одного из реагирующих веществ Отводить
- 14. Влияние давления на смещение равновесия Влияние давления на состояние равновесия проявляется только при наличии в системе
- 15. Влияние давления на смещение равновесия При повышении давления равновесие сдвигается в направлении образования веществ (исходных или
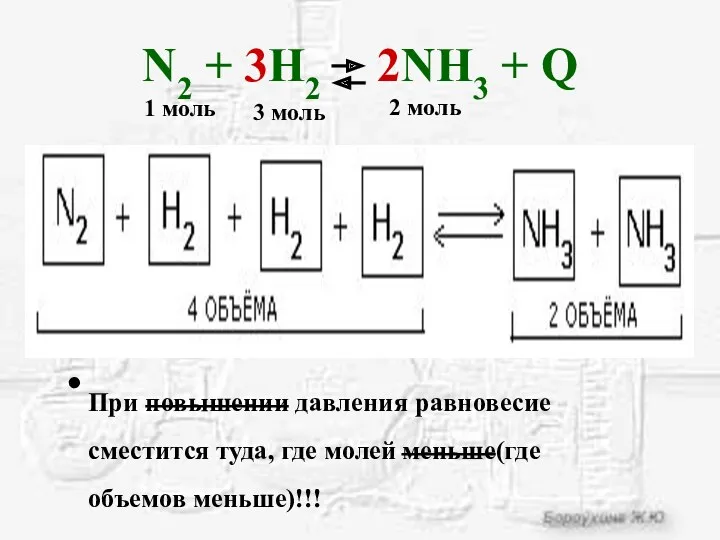
- 16. N2 + 3H2 2NH3 + Q При повышении давления равновесие сместится туда, где молей меньше(где объемов
- 17. Катализаторы не влияют на положение равновесия!
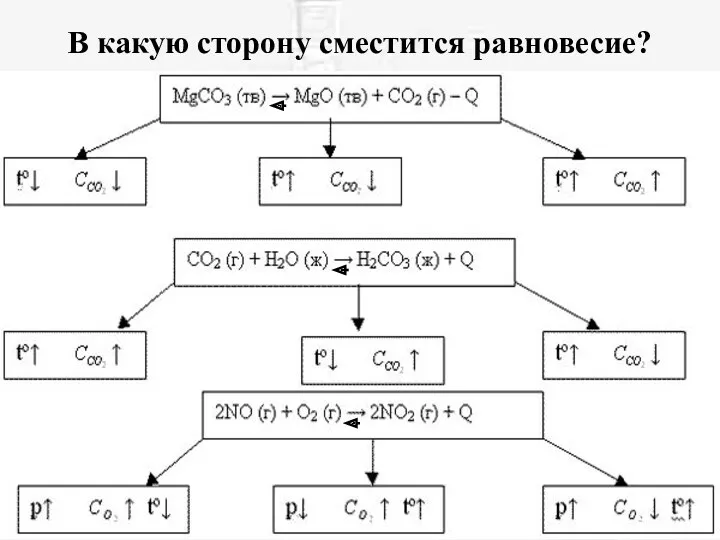
- 18. В какую сторону сместится равновесие?
- 20. Скачать презентацию













 Hello september
Hello september Творчество Т.Г. Шевченко
Творчество Т.Г. Шевченко Расчет смешивающих литейных бегунов с вертикально-вращающимися катками
Расчет смешивающих литейных бегунов с вертикально-вращающимися катками Поздравляем с Днём рождения!
Поздравляем с Днём рождения! Семейный праздник в 1 классе Папа, мама, я - дружная семья
Семейный праздник в 1 классе Папа, мама, я - дружная семья Ночная лирика и природа в поэзии Федора Ивановича Тютчева
Ночная лирика и природа в поэзии Федора Ивановича Тютчева Химико-термическая обработка
Химико-термическая обработка Проект Новогодний алфавит
Проект Новогодний алфавит Деятельность Молодежного Совета Санкт-Петербург – Витебского центра организации работы железнодорожных станций в 2016 году
Деятельность Молодежного Совета Санкт-Петербург – Витебского центра организации работы железнодорожных станций в 2016 году Конкурс рисунков
Конкурс рисунков Ответственность за нарушение законодательства по метрологии (Презентация)
Ответственность за нарушение законодательства по метрологии (Презентация) Городской парк, как искусственная экосистема, созданная человеком в арктике
Городской парк, как искусственная экосистема, созданная человеком в арктике Синтоизм
Синтоизм Башҡорт тел картинаһында ағас концепты
Башҡорт тел картинаһында ағас концепты Своя игра. 7 класс
Своя игра. 7 класс Клиническая токсикология
Клиническая токсикология Буквенная запись свойств сложения и вычитания
Буквенная запись свойств сложения и вычитания Бас пен бет жарақаты кезіндегі қан кетуді тоқтату әдістері
Бас пен бет жарақаты кезіндегі қан кетуді тоқтату әдістері Организация работы с детьми группы риска
Организация работы с детьми группы риска Презентация Ёлочный шар торцевание
Презентация Ёлочный шар торцевание Ball Mill Ventilation
Ball Mill Ventilation Игра - пособие Русская матрешка
Игра - пособие Русская матрешка Руководство по настольному теннису для судей
Руководство по настольному теннису для судей Урок – основная форма организации занятий в школе
Урок – основная форма организации занятий в школе Злаковые культуры
Злаковые культуры Исследовательская работа на тему: Годонимы города Ак-Довурак
Исследовательская работа на тему: Годонимы города Ак-Довурак Государственный стандарт дипломных и курсовых проектов
Государственный стандарт дипломных и курсовых проектов Computer systems. Programming paradigms. Systems life cycle
Computer systems. Programming paradigms. Systems life cycle