Содержание
- 2. Положение в таблице Строение атома Физические свойства История открытия Минералы Получение Химические свойства Применение
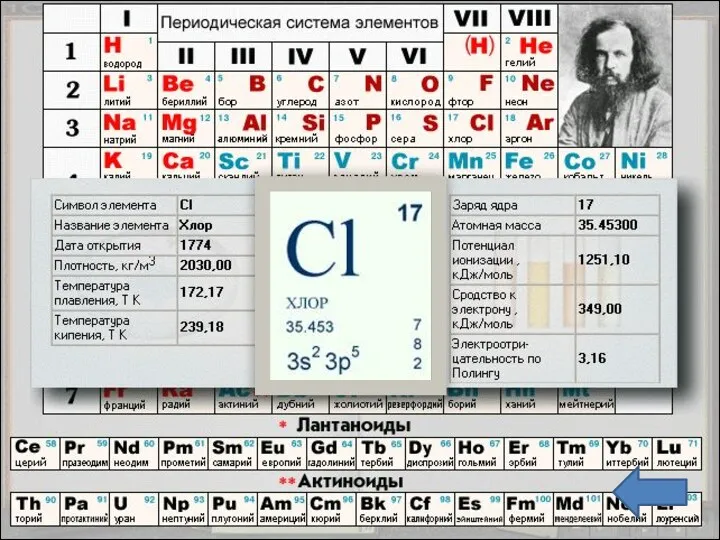
- 3. Положение в таблице Хлор - химический элемент седьмой группы, главной подгруппы, третьего периода периодической системы элементов
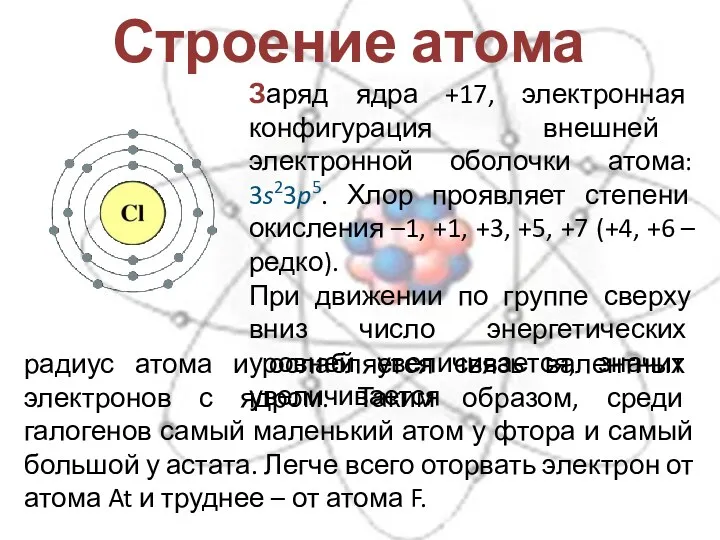
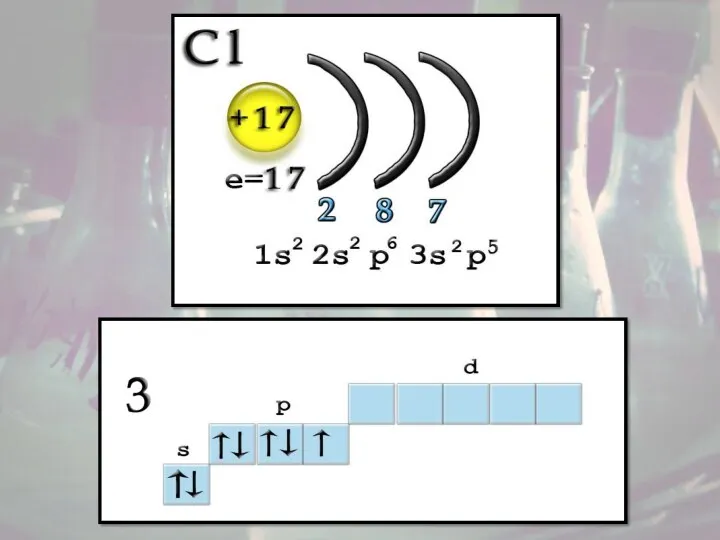
- 5. Строение атома Заряд ядра +17, электронная конфигурация внешней электронной оболочки атома: 3s23p5. Хлор проявляет степени окисления
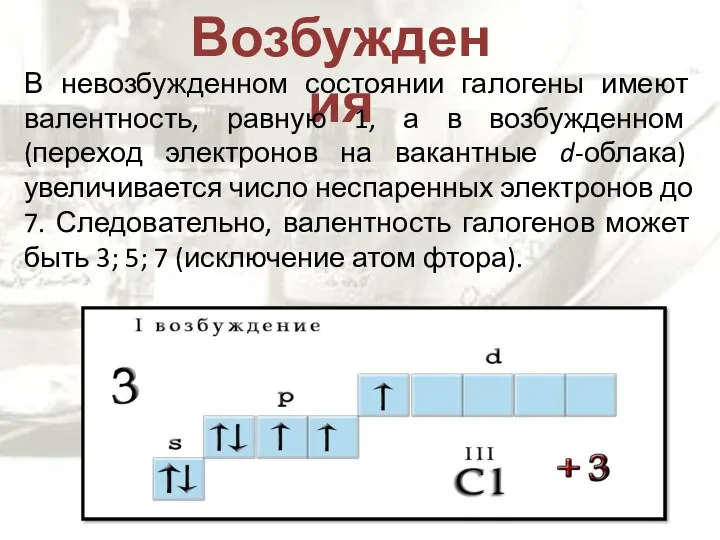
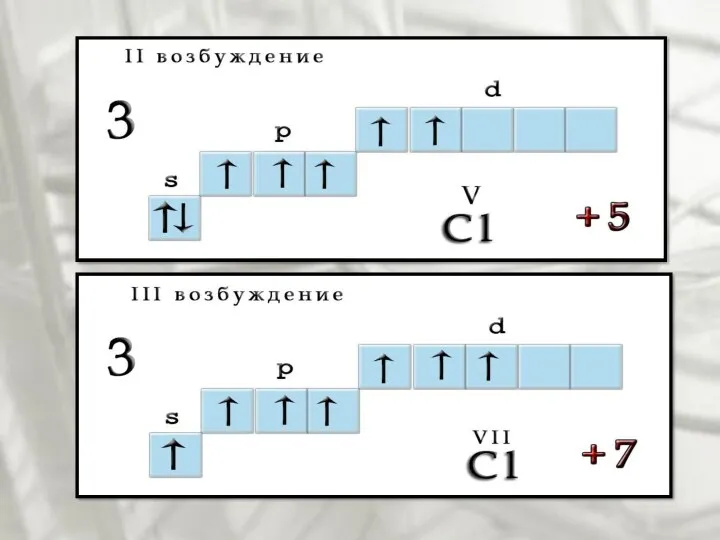
- 7. Возбуждения В невозбужденном состоянии галогены имеют валентность, равную 1, а в возбужденном (переход электронов на вакантные
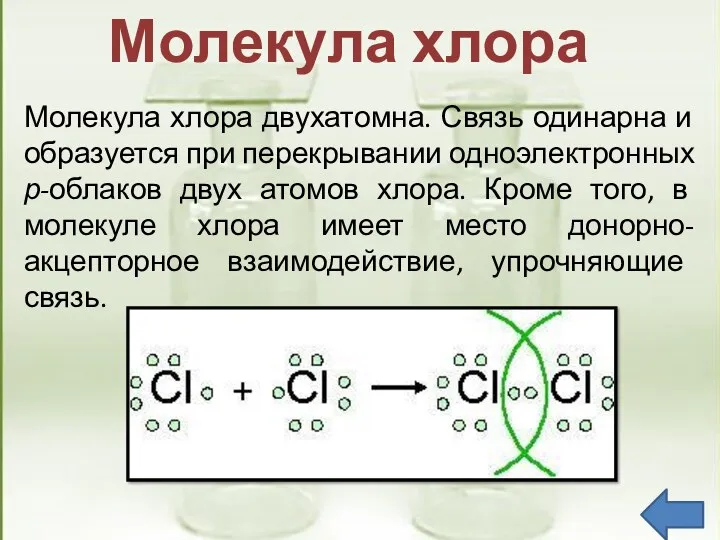
- 9. Молекула хлора двухатомна. Связь одинарна и образуется при перекрывании одноэлектронных р-облаков двух атомов хлора. Кроме того,
- 10. Физические свойства С возрастанием молекулярной массы температуры плавления и кипения веществ, состоящих из молекул одинакового строения,
- 11. Физические свойства Хлор – ядовитый газ желто-зеленого цвета с резким запахом. Это первое химическое оружие. Во
- 12. Физические свойства
- 13. История открытия Первым из галогенов был открыт хлор (К. Шееле, 1774 год). Полученный желто-зеленый газ шведский
- 14. В природе встречается два стабильных изотопа хлора:35Cl (75,77%) и 37Cl (24,23%). Содержание хлора в земной коре
- 15. Минералы Каменная соль = поваренная соль = галит Карналлит Сильвин
- 16. Получение Основной промышленный способ получения хлора – электролиз хлоридов щелочных металлов (NaCl, KCl). Также его получают
- 17. Получение 2KMnO4+16HCl (конц.)= 2KCl + 2MnCl2 + 8H2O + 5Cl2
- 18. Химические свойства Хлор – активный окислитель. Энергично реагирует с металлами и большинством неметаллов (за исключением O2,
- 19. Хлор - один из самых активных неметаллов. При взаимодействии с металлами с переменной валентностью (Fe, Cr)
- 20. Cu+Cl2=CuCl2 2Fe+3Cl2 = 2FeCl3
- 21. H2 + Cl2 = 2 HCl(на свету) С Неметаллами 2Cl2 + C = CCl4 3Cl2 +
- 22. Образует соединения с другими галогенами: Cl2 + F2 = 2ClF Cl2 + 3F2 = 2ClF3, t
- 23. Хлор растворяется вводе (в 1 объеме воды растворяется 2 объема хлора) с образованием "хлорной воды": Cl2
- 24. С Бескислородными Кислотами Cl2 + HBr = 2HCl + Br2 Cl2 + HI = 2HCl +
- 25. Хлор в органике Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул
- 26. Применение хлора Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: Основным компонентом отбеливателей является
- 27. Для обеззараживания воды — «хлорирования». В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов,
- 29. Скачать презентацию




















 Правовое регулирование рекламной деятельности в Российской Федерации
Правовое регулирование рекламной деятельности в Российской Федерации Сад металлургов и парк Гагарина
Сад металлургов и парк Гагарина Деление десятичных дробей на 10, 100, 1000
Деление десятичных дробей на 10, 100, 1000 kuzmuk_11
kuzmuk_11 Государственный бюджет, 8 класс
Государственный бюджет, 8 класс Презентация Христос и Его крест
Презентация Христос и Его крест Артикуляционная гимнастика
Артикуляционная гимнастика Подарок своими руками
Подарок своими руками Архитектура, частотный и энергетический планы приемопередатчиков мобильной
Архитектура, частотный и энергетический планы приемопередатчиков мобильной Элементы внешней среды. АО Костромской завод автокомпонентов
Элементы внешней среды. АО Костромской завод автокомпонентов Человек в обществе
Человек в обществе трудности в жизни ребенка
трудности в жизни ребенка Классификация судов
Классификация судов Древнегреческие чудеса света, презентация 7 класс
Древнегреческие чудеса света, презентация 7 класс Подготовка к участию в практических олимпиадах по робототехнике
Подготовка к участию в практических олимпиадах по робототехнике Неделя театра в средней группе
Неделя театра в средней группе технология совершенствования вычислительных навыков на уроках математики
технология совершенствования вычислительных навыков на уроках математики Как написать свою первую научную статью?
Как написать свою первую научную статью? Динамическое развитие общества
Динамическое развитие общества День безпечного Інтернету
День безпечного Інтернету На какие вопросы может дать ответ астрология?
На какие вопросы может дать ответ астрология? Принципы построения параллельных вычислительных систем. Лекция 2
Принципы построения параллельных вычислительных систем. Лекция 2 Новообразования надпочечников. Лечение согласно клиническим протоколам и международным рекомендациям
Новообразования надпочечников. Лечение согласно клиническим протоколам и международным рекомендациям Функции продавца
Функции продавца Устройство водопроводного крана и смесителя. 6 класс
Устройство водопроводного крана и смесителя. 6 класс Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Теория и практика профессиональных взаимодействий
Теория и практика профессиональных взаимодействий Монтаж кабельных линий напряжением до 35 кВ
Монтаж кабельных линий напряжением до 35 кВ