Слайд 2
Слайд 3

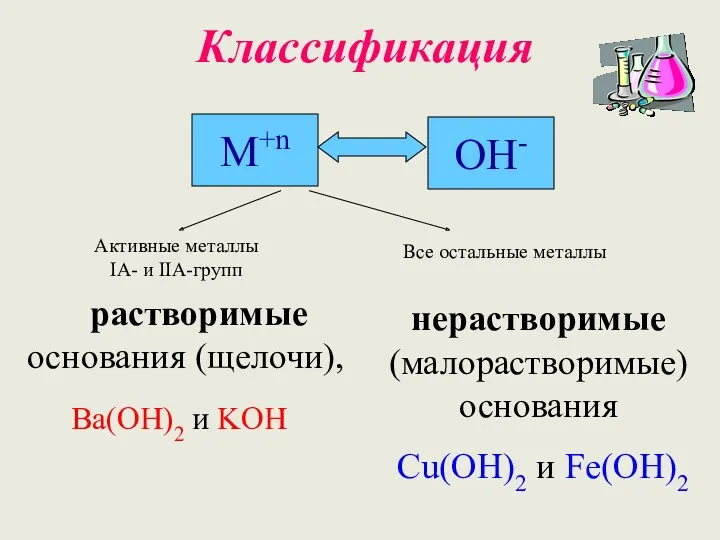
Химические свойства растворимых оснований
Основания изменение окраски индикаторов
Основание +
кислота → соль + вода
(реакция нейтрализации)
2KOH + H2SO4 → K2SО4 + 2H2O
Основание + кислотный оксид → соль + вода 2KOH + CO2 → K2CO3 + H2O
Основание + соль → новая соль + новое основание
6KOH + Fe2(SO4)3 → 3K2SO4 + 2Fe(OH)3
Слайд 4

Химические свойства нерастворимых оснований
Основание + кислота → соль + вода
(реакция нейтрализации )
Cu(OH)2+ 2HCl → CuСl2 + 2H2O
При нагревании разлагаются с образованием соответствующего оксида и воды
Cu(OH)2 → CuO + 2H2O
Слайд 5
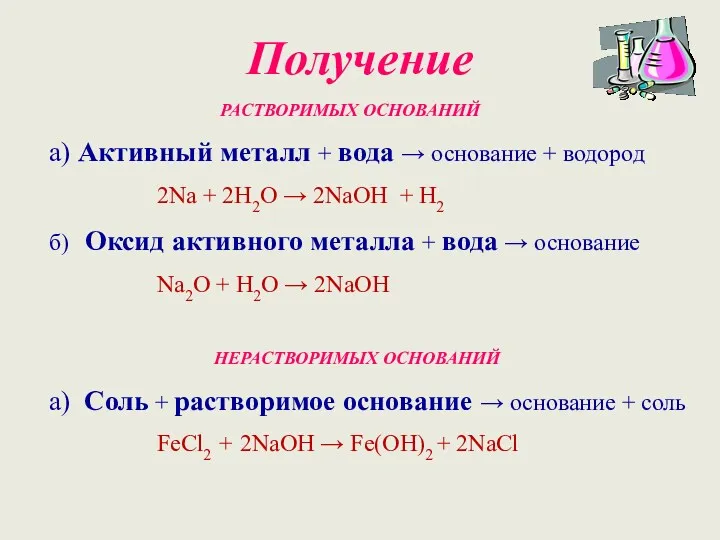
Получение
РАСТВОРИМЫХ ОСНОВАНИЙ
а) Активный металл + вода → основание +
водород
2Na + 2H2O → 2NaOH + H2
б) Оксид активного металла + вода → основание
Na2O + H2O → 2NaOH
НЕРАСТВОРИМЫХ ОСНОВАНИЙ
а) Соль + растворимое основание → основание + соль
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl




 Сухие строительные смеси ГЕРКУЛЕС. Шпатлевки
Сухие строительные смеси ГЕРКУЛЕС. Шпатлевки Мастер-класс Новогодняя игрушка Елочка
Мастер-класс Новогодняя игрушка Елочка ПрезентацияSlava 130420A
ПрезентацияSlava 130420A Радио Комсомольская правда. Новые программы в эфире. Рекламные возможности
Радио Комсомольская правда. Новые программы в эфире. Рекламные возможности Измельчительно-режущее оборудование
Измельчительно-режущее оборудование Компания MasterMould. Высокоскоростная штамповка
Компания MasterMould. Высокоскоростная штамповка Урок в 11 химико-биологическом классе по теме: Особенности свойств отдельных классов неорганических и органических веществ на примере лекарственных средств
Урок в 11 химико-биологическом классе по теме: Особенности свойств отдельных классов неорганических и органических веществ на примере лекарственных средств Системы обучения в начальной школе
Системы обучения в начальной школе Предприятие – основное звено рыночного хозяйствования
Предприятие – основное звено рыночного хозяйствования Талшықты лазер
Талшықты лазер С праздником 8 марта
С праздником 8 марта Свобода в деятельности человека
Свобода в деятельности человека Организация воспитательно-образовательной работы с детьми раннего возраста в группе кратковременного пребывания
Организация воспитательно-образовательной работы с детьми раннего возраста в группе кратковременного пребывания Трапеция. Свойства трапеции
Трапеция. Свойства трапеции Презентация для детей старшего дошкольного возраста Как добывают уголь
Презентация для детей старшего дошкольного возраста Как добывают уголь School days
School days Геометрические задачи С4, по материалам ЕГЭ. Подобие треугольников
Геометрические задачи С4, по материалам ЕГЭ. Подобие треугольников Расчет элементов железобетонных конструкций по предельным состояниям второй группы
Расчет элементов железобетонных конструкций по предельным состояниям второй группы Венерические заболевания
Венерические заболевания презентация вкр (2)
презентация вкр (2) Методические рекомендации по построению предметно-развивающей среды в соответствии с ФГОС в группе раннего возраста.
Методические рекомендации по построению предметно-развивающей среды в соответствии с ФГОС в группе раннего возраста. Кухни Боснии, Герцеговины, Хорватии и Сербии
Кухни Боснии, Герцеговины, Хорватии и Сербии Гордость театральной сцены Башкортостана
Гордость театральной сцены Башкортостана Сократительная функция всех типов мышц
Сократительная функция всех типов мышц Врожденная непроходимость ЖКТ у детей
Врожденная непроходимость ЖКТ у детей Трахеобронхомегалия (синдром Мунье-Куна)
Трахеобронхомегалия (синдром Мунье-Куна) Линейная алгебра. Лекционно-практические занятия
Линейная алгебра. Лекционно-практические занятия Маркетинговые исследования
Маркетинговые исследования