Содержание
- 2. Элемент, о котором пойдет речь на уроке, А.Е. Ферсман назвал “элементом мысли”. Открыт этот элемент в
- 3. Фосфор был открыт немецким алхимиком X. Брэндом в 1669 г. Позже А. Лавуазье доказал, что фосфор
- 4. период Фосфор как химический элемент III группа VА валентных электронов 5 степени окисления -3, +3, +5
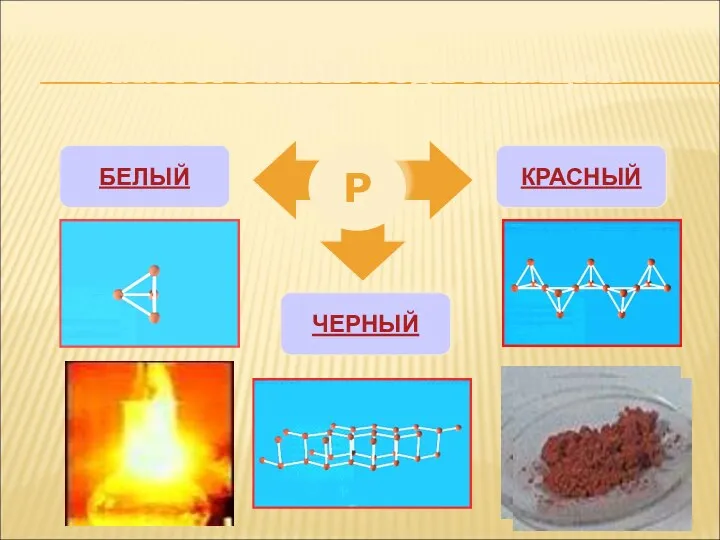
- 5. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Р БЕЛЫЙ КРАСНЫЙ ЧЕРНЫЙ
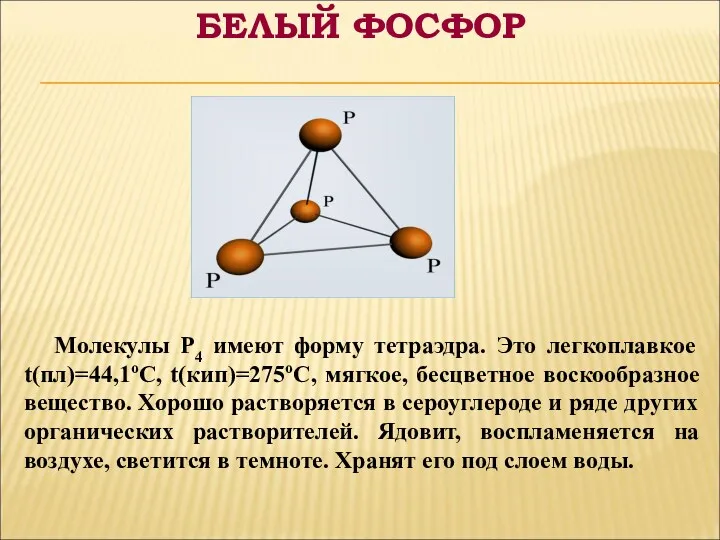
- 6. Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в
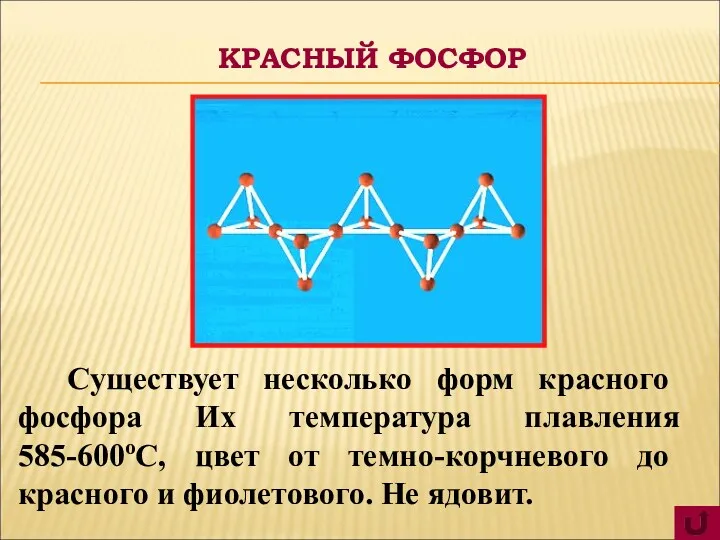
- 8. Существует несколько форм красного фосфора Их температура плавления 585-600оС, цвет от темно-корчневого до красного и фиолетового.
- 10. Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником.
- 12. Белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой. Красный фосфор не
- 13. ХИМИЧЕСКИЕ СВОЙСТВА С металлами: Ca + P = C неметаллами: P + O2 = P +
- 14. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
- 15. В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха
- 16. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ, ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫ В ЗУБАХ И КОСТЯХ ФОСФОРИТ БИРЮЗА
- 17. НАХОЖДЕНИЕ ФОСФОРА В ПРИРОДЕ. В земной коре содержится около 0,08% фосфора. В природе фосфор содержится в
- 18. ФОСФОР В ОРГАНИЗМЕ ЧЕЛОВЕКА. Фосфор входит в состав белковых веществ в виде различных соединений. Содержание фосфора
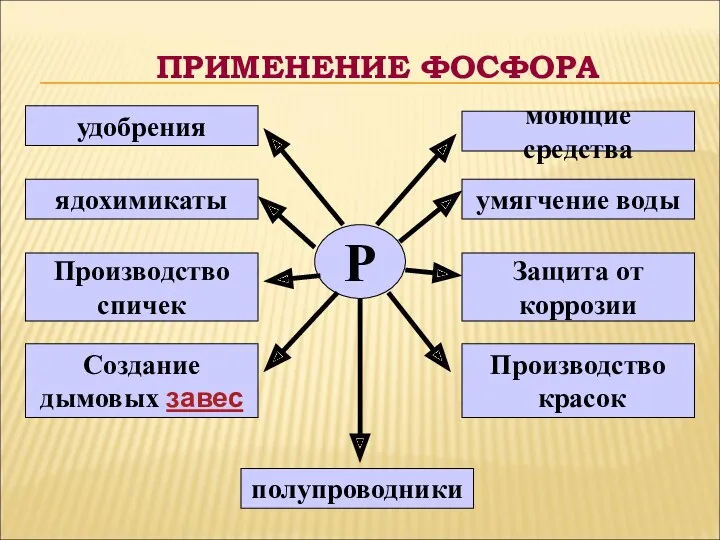
- 19. ПРИМЕНЕНИЕ ФОСФОРА Р удобрения ядохимикаты Производство спичек Создание дымовых завес полупроводники Производство красок Защита от коррозии
- 21. Скачать презентацию














 Военная служба
Военная служба Stepan Tkachenko
Stepan Tkachenko Кто говорит, что на войне не страшно, тот ничего не знает о войне…
Кто говорит, что на войне не страшно, тот ничего не знает о войне… Внешнеэкономическая деятельность ОАО Станкостроительный завод им. Кирова
Внешнеэкономическая деятельность ОАО Станкостроительный завод им. Кирова Презентация Культура речи и средства эффективного общения
Презентация Культура речи и средства эффективного общения Гражданская оборона
Гражданская оборона Моделювання динамічних систем
Моделювання динамічних систем Природно-территориальные комплексы Урала
Природно-территориальные комплексы Урала Структурное программирование: следование, ветвление, циклы
Структурное программирование: следование, ветвление, циклы Современные здоровьесберегающие технологии
Современные здоровьесберегающие технологии Нормативные документы, регламентирующие содержание общего среднего образования
Нормативные документы, регламентирующие содержание общего среднего образования Использование игровых упражнений и игр с детьми дошкольного возраста с тяжёлым нарушением речи, как профилактика дисграфии и дислексии.
Использование игровых упражнений и игр с детьми дошкольного возраста с тяжёлым нарушением речи, как профилактика дисграфии и дислексии. Презентация Тыва алфавит
Презентация Тыва алфавит Обзор важнейших абиотических факторов среды и адаптации организмов
Обзор важнейших абиотических факторов среды и адаптации организмов Области применения ИКТ для развития дошкольников
Области применения ИКТ для развития дошкольников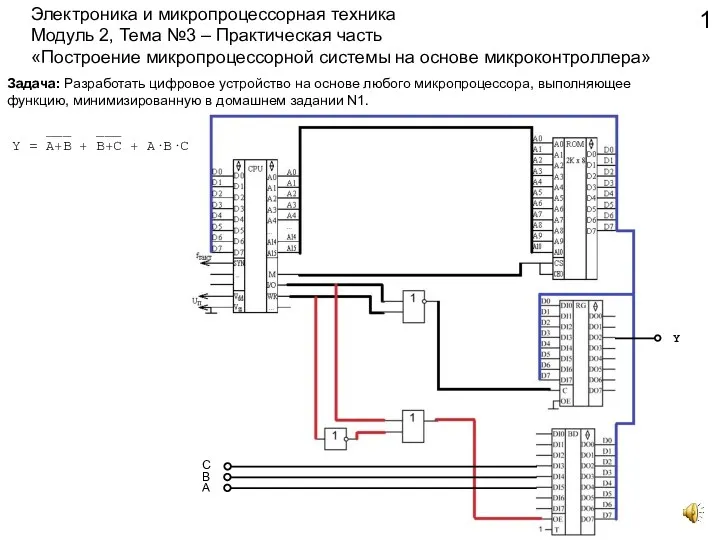 Электроника и микропроцессорная техника
Электроника и микропроцессорная техника Пришла Коляда
Пришла Коляда Степень окисления. Бинарные соединения. Диск
Степень окисления. Бинарные соединения. Диск Религия. Понятие религии
Религия. Понятие религии Выступление на педагогическом совете Использвание ИКТ.
Выступление на педагогическом совете Использвание ИКТ. Соборы России
Соборы России Знаки химических элементов
Знаки химических элементов Звуко-буквенный анализ. Плакаты - 1б Диск
Звуко-буквенный анализ. Плакаты - 1б Диск Дозирующие устройства жидкости
Дозирующие устройства жидкости Открытое занятие по народоведению Чувашская Республика
Открытое занятие по народоведению Чувашская Республика Планировка дома
Планировка дома Smart irrigation system
Smart irrigation system Современные системы компьютерного моделирования. Лекция 9
Современные системы компьютерного моделирования. Лекция 9