Содержание
- 2. Задачи: познакомиться с типами химических связей ; научиться определять по молекулярной формуле соединения тип связей в
- 3. Что такое химическая связь? Ответ: Это взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
- 4. Различают четыре типа химических связей: Ионная связь. Ковалентная связь. Металлическая связь. Водородная связь. Рис.1
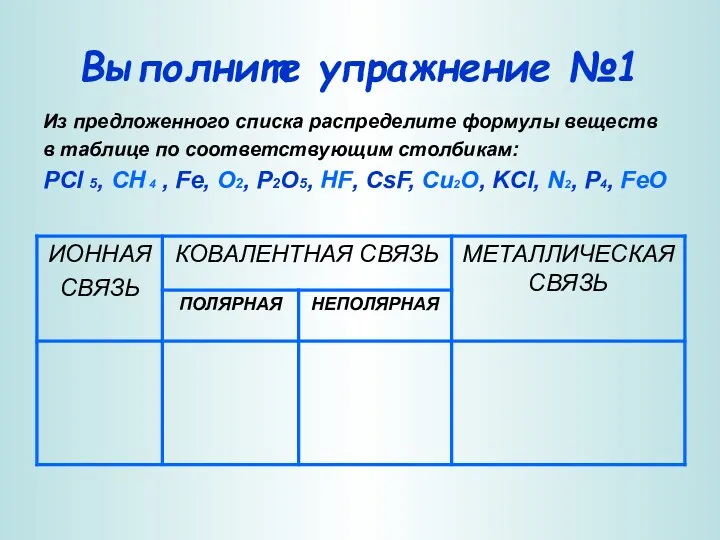
- 5. Выполните упражнение №1 Из предложенного списка распределите формулы веществ в таблице по соответствующим столбикам: PCl 5,
- 6. Выполните упражнение №2 Как меняется полярность связи в ряду: HCl – H2Se – AsH3
- 7. Выполните упражнение №3 Покажите образование ионной связи в соединениях: Cu2O, KCl.
- 8. Выполните упражнение №4 Покажите образование ковалентных связей и укажите их тип в соединениях: PCl 5, CH
- 9. Выполните упражнение №5 Определите количество σ- и π- связей в формулах молекул: SF2, SO3, H2SO4.
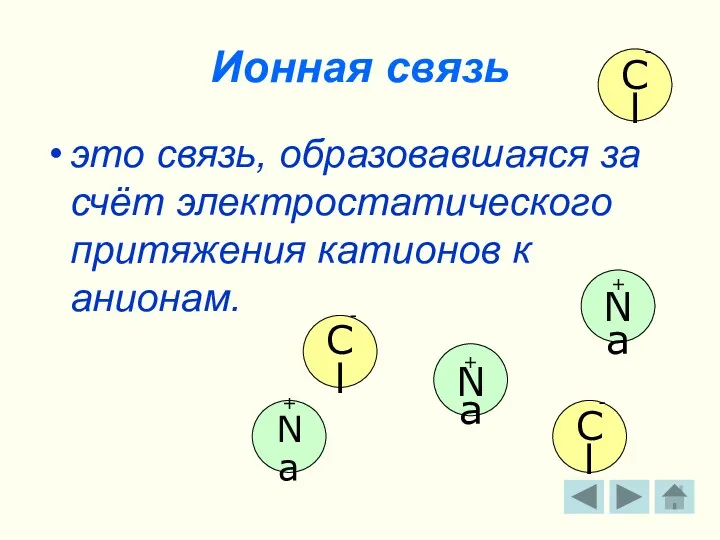
- 10. Ионная связь это связь, образовавшаяся за счёт электростатического притяжения катионов к анионам. + Na - Cl
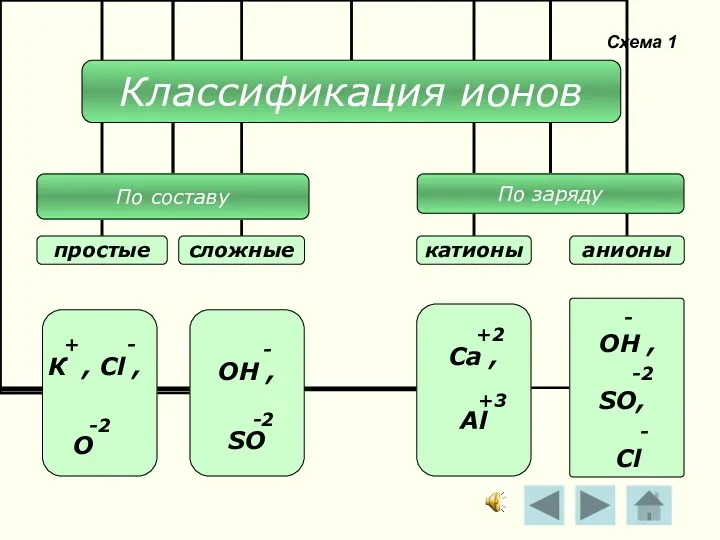
- 11. Схема 1 - ОН , -2 SO, - Cl
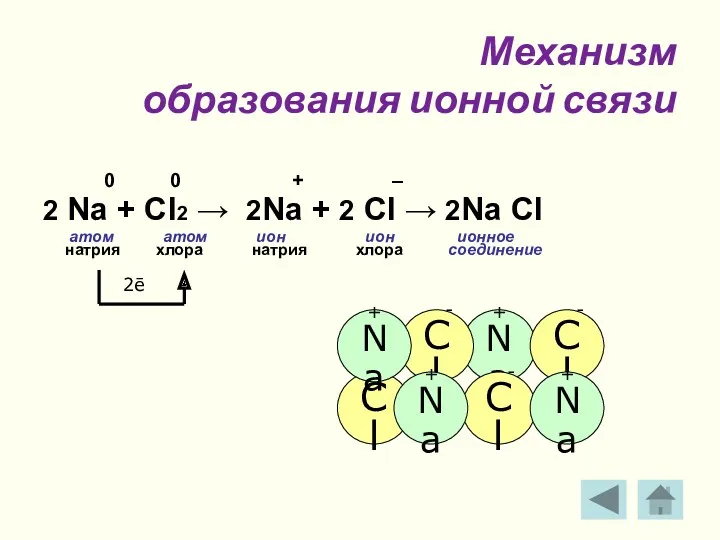
- 12. Механизм образования ионной связи 0 0 + – 2 Na + Cl2 → 2Na + 2
- 13. Ковалентная связь это связь, возникает между атомами за счёт образования общих электронных пар. ē ē ē
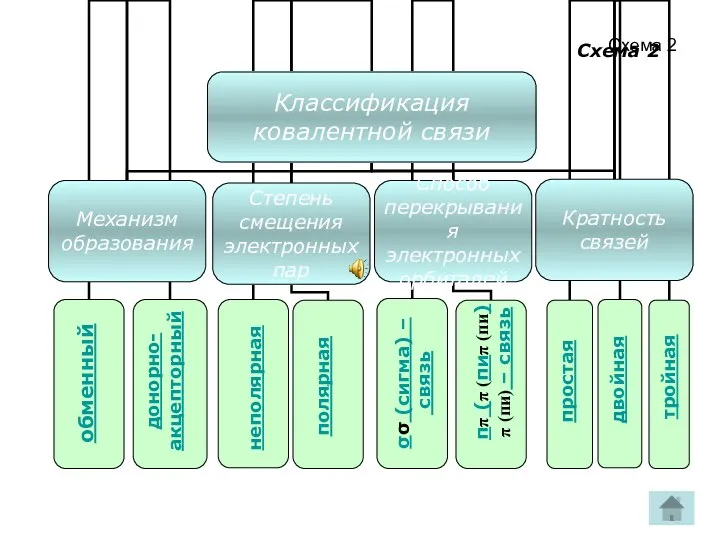
- 14. Схема 2 обменный донорно- акцепторный полярная неполярная σσ (сигма) – связь ππ (π (пиπ (пи)π (пи)
- 15. Обменный механизм образования ковалентной связи ☼ Действует, когда атомы образуют общие электронные пары за счёт объединения
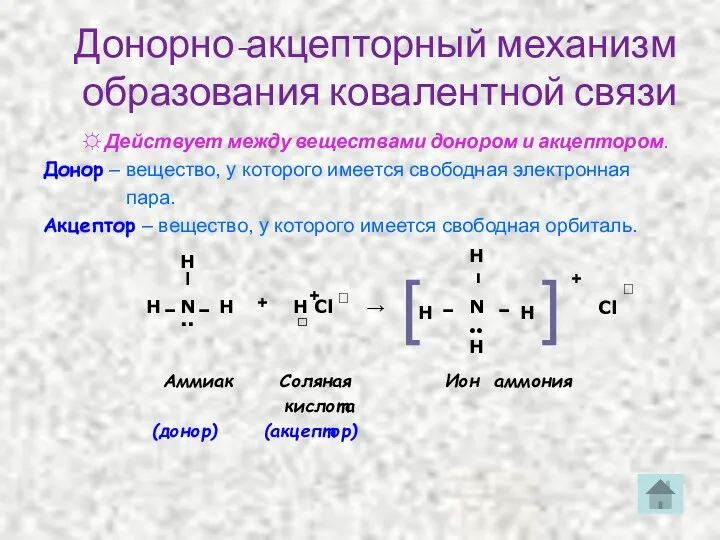
- 16. Донорно-акцепторный механизм образования ковалентной связи ☼ Действует между веществами донором и акцептором. Донор – вещество, у
- 17. Степень смещения электронных пар ☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ элементов. Ряд электроотрицательности: F, O, N, C l, Br,
- 18. Кратность ковалентной связи ☼Зависит от числа общих электронных пар, связывающих атомы. Бывает: ПРОСТАЯ « - »
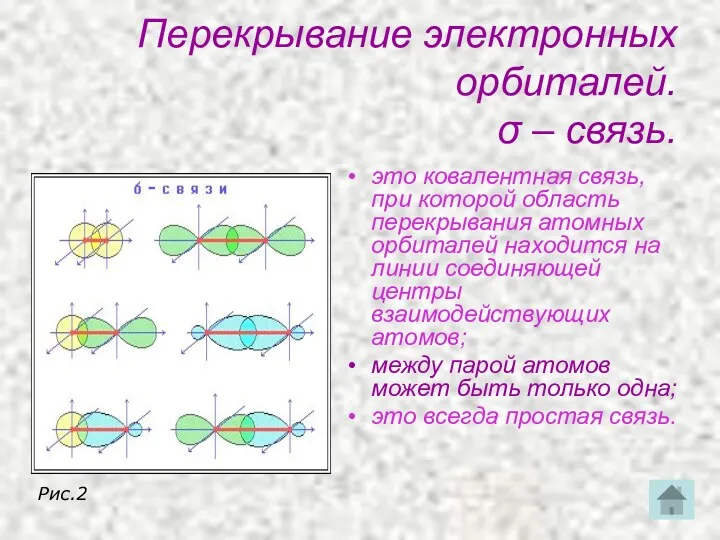
- 19. Перекрывание электронных орбиталей. σ – связь. это ковалентная связь, при которой область перекрывания атомных орбиталей находится
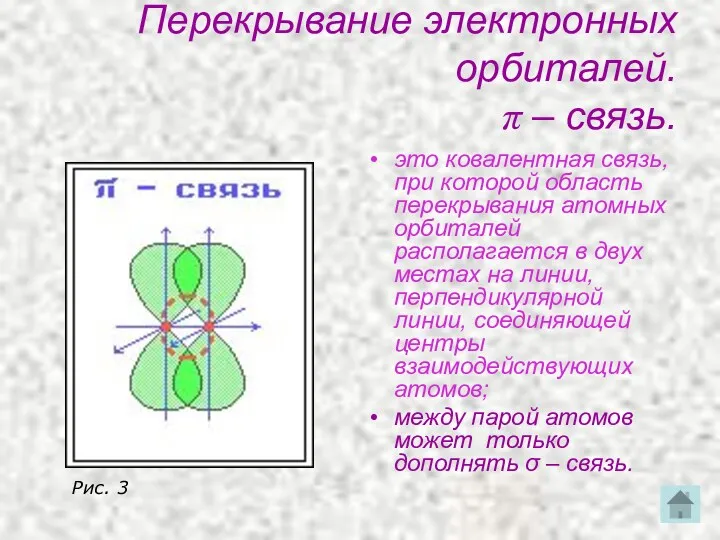
- 20. Перекрывание электронных орбиталей. π – связь. это ковалентная связь, при которой область перекрывания атомных орбиталей располагается
- 21. Металлическая связь это связь, которую осуществляют относительно свободные электроны между ионами металлов в металлической решётке. n+
- 22. Механизм образования металлической связи: 0 n+ М - nē = М Например: для элементов (металлов) Ι
- 23. Водородная связь Межмолекулярная водородная связь – это связь между атомами водорода одной молекулы и сильноотрицательными элементами(O,
- 24. Водородная связь Внутримолекулярная водородная связь – эта связь возможна при наличии в одной молекуле и электроноакцепторной
- 26. Скачать презентацию















 Бассүйек-ми жарақаты
Бассүйек-ми жарақаты Объект, предмет и основные парадигмы социологии
Объект, предмет и основные парадигмы социологии Рейди мэйд в искусстве XX века
Рейди мэйд в искусстве XX века Тема №4. Заготовка конструкций и организация строительства низководных мостов. Занятие №2. Район заготовки мостовых конструкций
Тема №4. Заготовка конструкций и организация строительства низководных мостов. Занятие №2. Район заготовки мостовых конструкций Фрезерование. Обработка торцевых канавок
Фрезерование. Обработка торцевых канавок Суперкаркасник
Суперкаркасник Презентация к занятию по теме История шашек
Презентация к занятию по теме История шашек Артериальная гипертония. Антигипертензивные препараты
Артериальная гипертония. Антигипертензивные препараты Тиристоры и особенности их применения в преобразовательных устройствах. (Тема 1)
Тиристоры и особенности их применения в преобразовательных устройствах. (Тема 1) Грузовое судно танкер
Грузовое судно танкер Возникновение и развитие педагогики
Возникновение и развитие педагогики Мой край родной 3
Мой край родной 3 презентация 15.04
презентация 15.04 Пространственая область ЦИТ
Пространственая область ЦИТ презентация на тему Развитие интегративных качеств личности с помощью игры драматизации
презентация на тему Развитие интегративных качеств личности с помощью игры драматизации Выразительные средства словообразования
Выразительные средства словообразования Мешочек для новогоднего подарка
Мешочек для новогоднего подарка Основы сердечно-легочной реанимации
Основы сердечно-легочной реанимации Родительское собрание Отметка. Оценка. Как к ней относиться
Родительское собрание Отметка. Оценка. Как к ней относиться Помощь мигрантам как направление социальной работы
Помощь мигрантам как направление социальной работы Путешествие по Астраханскому кремлю создада учитель начальных классов МБОУ СОШ №14 города Астрахани Кожарина И.В. Диск
Путешествие по Астраханскому кремлю создада учитель начальных классов МБОУ СОШ №14 города Астрахани Кожарина И.В. Диск безопасное поведение на льду весна
безопасное поведение на льду весна Планетарные и дифференциальные механизмы
Планетарные и дифференциальные механизмы Презентация (1)
Презентация (1) Endangered species
Endangered species Средства разведки и разминирования минно-взрывных заграждений
Средства разведки и разминирования минно-взрывных заграждений С праздником, дорогие учителя
С праздником, дорогие учителя Тип кишечнополостные медузы
Тип кишечнополостные медузы