Содержание
- 2. Первый закон термодинамики – закон сохранения энергии Энергия не возникает из ничего и не исчезает бесследно,
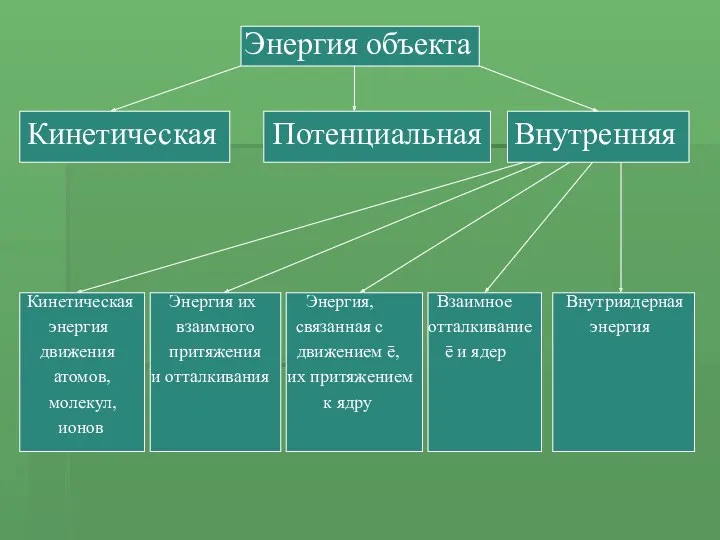
- 3. Энергия объекта Кинетическая Потенциальная Внутренняя Кинетическая Энергия их Энергия, Взаимное Внутриядерная энергия взаимного связанная с отталкивание
- 4. Е реагентов > Е продуктов Энергия выделяется в окружающую среду Реакции, при которых выделяется энергия и
- 5. Е реагентов Энергия поглощается из окружающей среды, температура системы понижается Реакции, при протекании которых энергия поглощается
- 6. Энергия, которая выделяется или поглощается в химической реакции, называется тепловым эффектом реакции. Тепловой эффект реакции выражается
- 7. Для расчета тепловых эффектов реакций используют значения величин теплот образования исходных веществ и продуктов реакции Теплота
- 8. Закон Гесса (1840) Тепловой эффект химической реакции не зависит от промежуточных стадий (при условии, что исходные
- 9. Следствие из закона Гесса Тепловой эффект химической реакции равен сумме теплот образования всех продуктов реакции минус
- 10. Fe2O3 + 2Al = 2Fe + Al2O3 + Qр По справочнику: Qобр(Al2O3) = 1670 кДж/моль Qобр(Fe2O3)
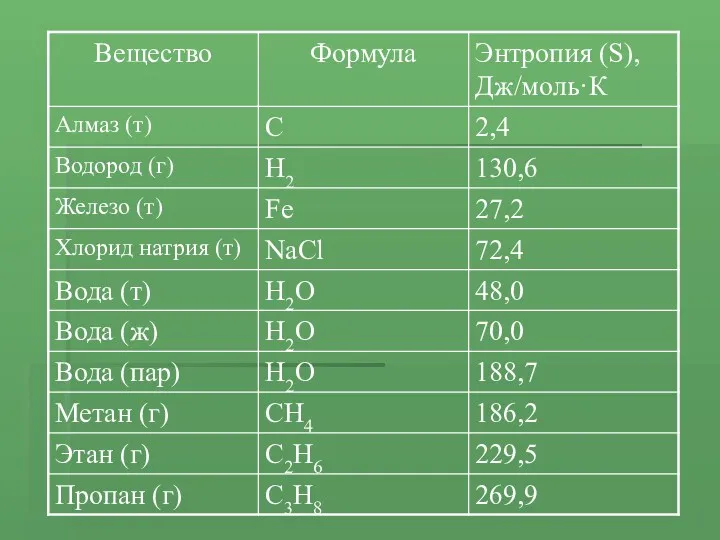
- 11. Энтальпия (теплосодержание) – это величина, которая характеризует запас энергии в веществе. ΔH = ΣHпродукты – ΣHреагенты
- 12. Движущая сила реакций Для экзотермических реакций – стремление системы к состоянию с наименьшей внутренней энергией. Для
- 14. Выводы Направление химической реакции определяется двумя факторами: стремлением к уменьшению внутренней энергии и стремлением к увеличению
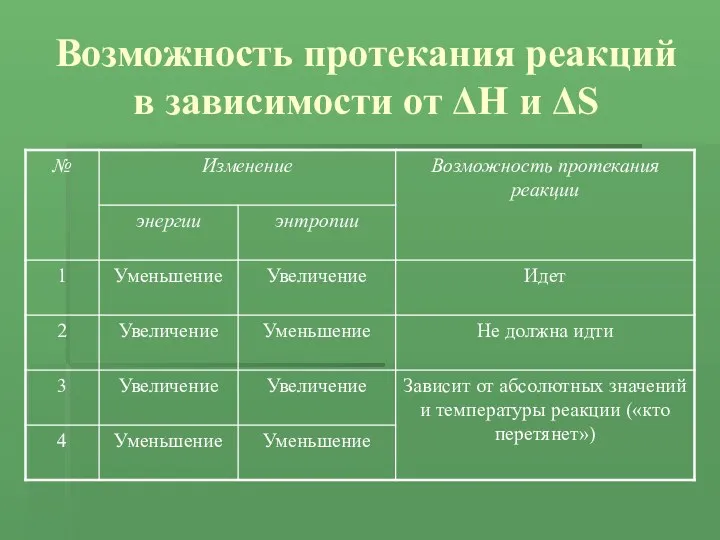
- 15. Возможность протекания реакций в зависимости от ΔH и ΔS
- 17. Скачать презентацию







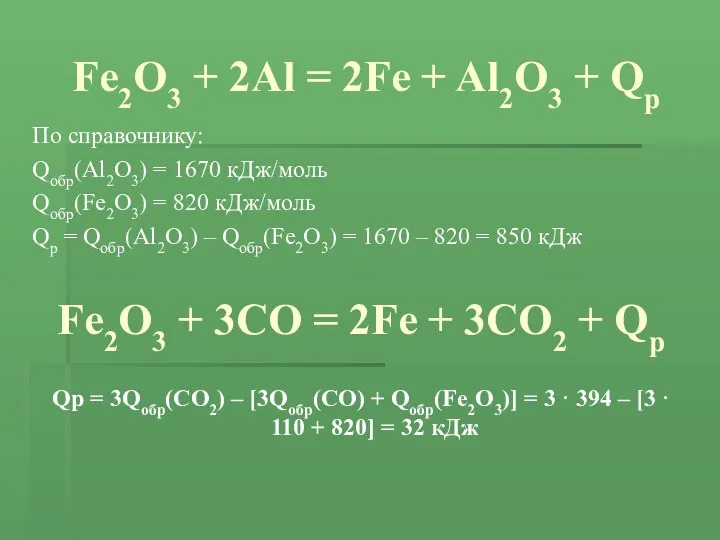



 презентация Основы электротехники
презентация Основы электротехники Лесной житель - белка
Лесной житель - белка Балки и балочные конструкции
Балки и балочные конструкции Акция Георгиевская ленточка
Акция Георгиевская ленточка Ввод информации в память компьютера
Ввод информации в память компьютера Санитарно-гигиеническая оценка МСЧ №9
Санитарно-гигиеническая оценка МСЧ №9 Презентация к работе. Актуальность темы История освоения космоса
Презентация к работе. Актуальность темы История освоения космоса Права и обязанности медицинских работников
Права и обязанности медицинских работников Морские инженерно-геологические изыскания
Морские инженерно-геологические изыскания Родительское собрание учащихся 9 классов в ОГЭ 2016/2017 учебном году
Родительское собрание учащихся 9 классов в ОГЭ 2016/2017 учебном году Презентация по творчеству А.Барто.
Презентация по творчеству А.Барто. Чрезвычайные ситуации техногенного характера и их классификация
Чрезвычайные ситуации техногенного характера и их классификация Из опыта работы Мастер класс Организация деятельностного подхода в обучении 2 часть
Из опыта работы Мастер класс Организация деятельностного подхода в обучении 2 часть Разработка нефтяных месторождений
Разработка нефтяных месторождений Художественно-эстетическое воспитание
Художественно-эстетическое воспитание Презентация Добро и зло
Презентация Добро и зло Исследовательский проект Пока мы помним...( Бургоякова, Ильина, Петричук)
Исследовательский проект Пока мы помним...( Бургоякова, Ильина, Петричук) С днем рождения Роман Николаевич!
С днем рождения Роман Николаевич! Школа Айболита
Школа Айболита Перечень личного снаряжения для однодневного турпохода и лекарственные, съедобные растения
Перечень личного снаряжения для однодневного турпохода и лекарственные, съедобные растения Распределительный закон умножения
Распределительный закон умножения Хирургические болезни
Хирургические болезни Курс на качество первые шаги работы по Программе поддержки ШНОР в 2020–2022 годах (Проект 500+)
Курс на качество первые шаги работы по Программе поддержки ШНОР в 2020–2022 годах (Проект 500+) Формулировка проблемы. Примерный круг проблем и авторская позиция
Формулировка проблемы. Примерный круг проблем и авторская позиция Композиторы: Барокко (1600-1750), Классика (1750-1820)
Композиторы: Барокко (1600-1750), Классика (1750-1820) Қазфосфат. Мықты жағы
Қазфосфат. Мықты жағы Белова Екатерина МАОУ гимназия №10 имени А.Е. Бочкина Здания, которые помнят тружениц тыла
Белова Екатерина МАОУ гимназия №10 имени А.Е. Бочкина Здания, которые помнят тружениц тыла Акварель. Астры
Акварель. Астры