Презентация с алгоритмами решения задач для 9 класса на тему: Химическое равновесие и способы его смещения. Принцип Ле Шателье
Содержание
- 2. Принцип Ле-Шателье: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (концентрация, температура, давление), то
- 3. При повышении температуры равновесие смещается в сторону эндотермической реакции (-Q), а при понижении температуры в сторону
- 4. При увеличении давления равновесие смещается в сторону меньших объемов, а при понижении давления в сторону больших
- 5. Условия смещения химического равновесия: 2. Давление (только для газообразных веществ) Например: Пример №2 СО2 (г) +
- 6. Чтобы сместить равновесие в сторону продуктов реакции (вправо), необходимо повысить концентрацию одного из исходных веществ (вступающих
- 7. Для справки: Катализаторы – это вещества, изменяющие (повышают) скорость химической реакции или ее направление, но сами
- 8. Химическое равновесие реакции 2NO2 (г) ↔ 2NO (г) + O2 (г) - Q смещается в сторону
- 9. 4. Химическое равновесие реакции S (тв) + Н2 (г) ↔ Н2S(г) + Q смещается в сторону
- 11. Скачать презентацию








 Методика подбора и анализа моделей аналогов
Методика подбора и анализа моделей аналогов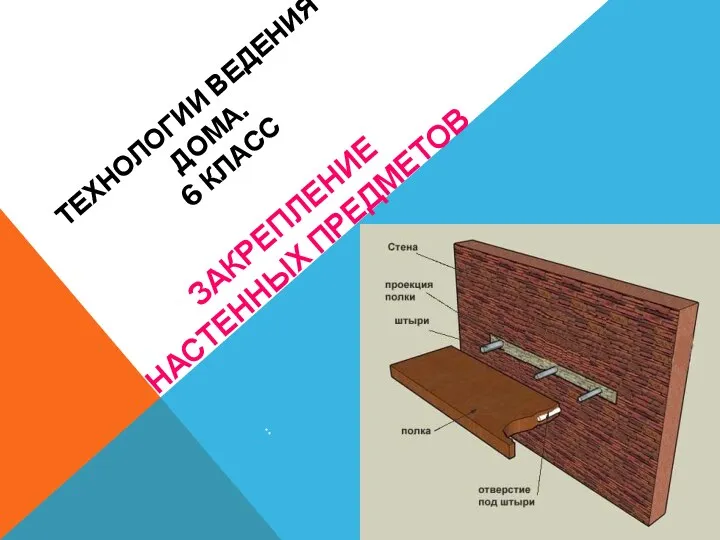 Закрепление изделий на стенах
Закрепление изделий на стенах Внутренний мир крестьянской избы
Внутренний мир крестьянской избы Основные термины и определения технической диагностики
Основные термины и определения технической диагностики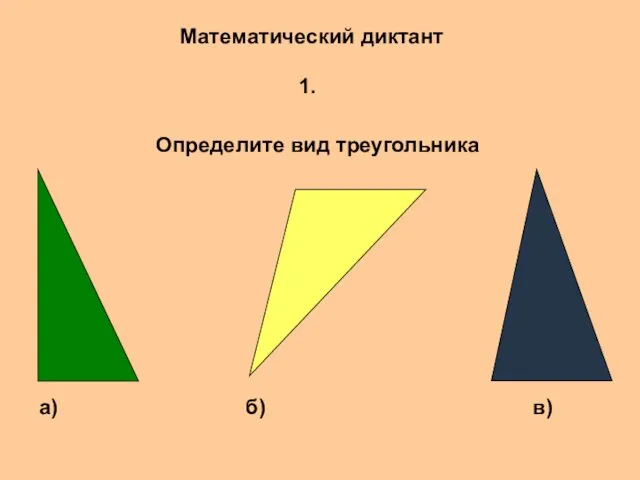 Виды треугольника
Виды треугольника ЕГЭ 2018 по обществознанию. Типичные ошибки
ЕГЭ 2018 по обществознанию. Типичные ошибки Сущность, формы и условия развития внешнеэкономических связей (ВЭД)
Сущность, формы и условия развития внешнеэкономических связей (ВЭД) Меланоцитарная система
Меланоцитарная система Электрификация фермы с разработкой внутреннего освещения на основе светодиодов
Электрификация фермы с разработкой внутреннего освещения на основе светодиодов Социальные изменения и процессы глобализации
Социальные изменения и процессы глобализации Итоговая игра Умники и умницы 6 класс
Итоговая игра Умники и умницы 6 класс Характеристика вагонів та їх основні частини
Характеристика вагонів та їх основні частини Основное противоречие современной системы образования
Основное противоречие современной системы образования Уроки музыки в общеобразовательной школе
Уроки музыки в общеобразовательной школе Сын есімнің сөйлемдегі қызметі
Сын есімнің сөйлемдегі қызметі Правописание имен собственных
Правописание имен собственных Атака Века пл с-13 А.И. Маринеско
Атака Века пл с-13 А.И. Маринеско Голландское искусство XVII в
Голландское искусство XVII в Мифические существа и животные в скульптуре Петербурга
Мифические существа и животные в скульптуре Петербурга Мастерилка 1 класс
Мастерилка 1 класс педагогический проект
педагогический проект Введение в управление проектами. Лекция 1
Введение в управление проектами. Лекция 1 Жизнь славян в раннее Средневековье
Жизнь славян в раннее Средневековье Та-та-та - тут везут кота
Та-та-та - тут везут кота Незулин. Показания, способ применения
Незулин. Показания, способ применения Реализация проектов в городе Заволжье
Реализация проектов в городе Заволжье Проценты каждый день!
Проценты каждый день! Основы профессиональной деятельности
Основы профессиональной деятельности