Содержание
- 2. Проверь свои знания 1.Написать ступенчатую диссоциацию: H2SO4, H3PO4, Cu(OH)2, AlCl3 2. Двухэлектронную внешнюю оболочку имеет ион:
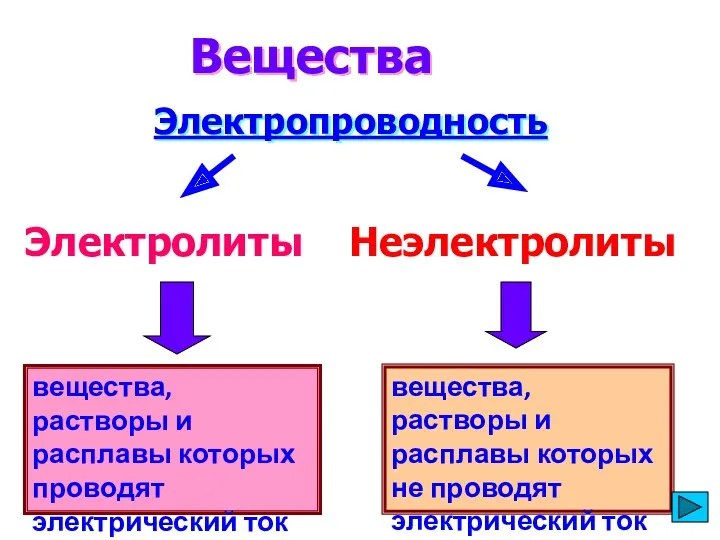
- 3. вещества, растворы и расплавы которых проводят электрический ток Вещества Электропроводность Электролиты Неэлектролиты вещества, растворы и расплавы
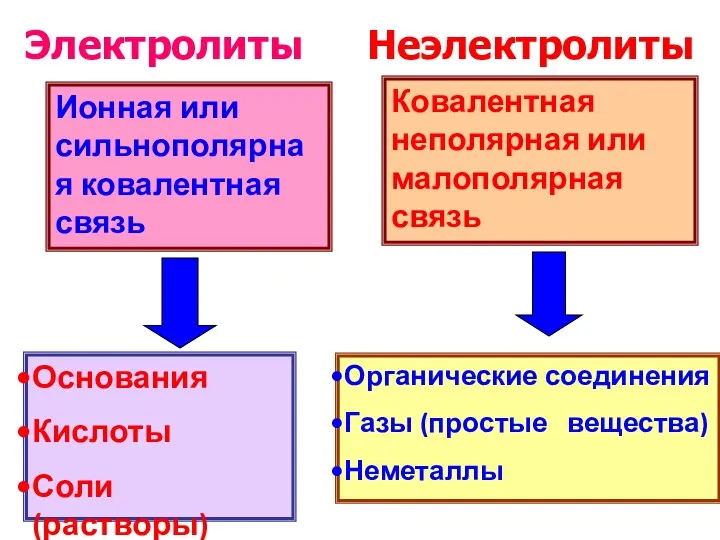
- 4. Ионная или сильнополярная ковалентная связь Основания Кислоты Соли(растворы) Ковалентная неполярная или малополярная связь Органические соединения Газы
- 5. Теория электролитической диссоциации С. А. Аррениус (1859-1927) процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить
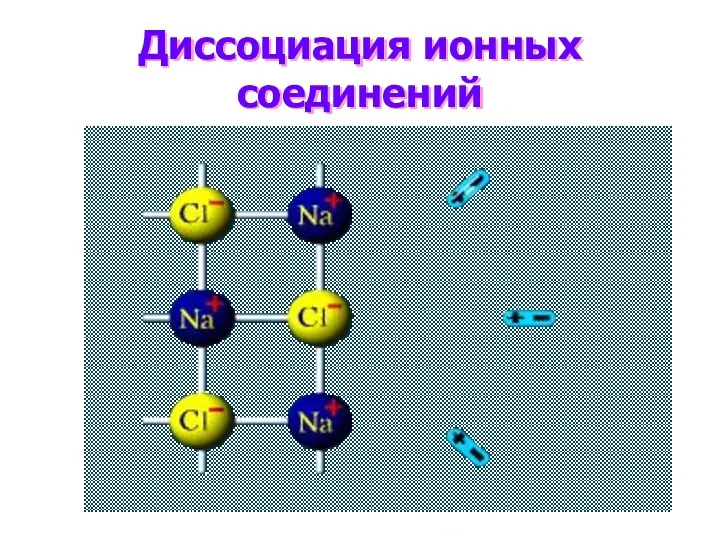
- 6. Диссоциация ионных соединений
- 7. Диссоциация соединений с ковалентной полярной связью
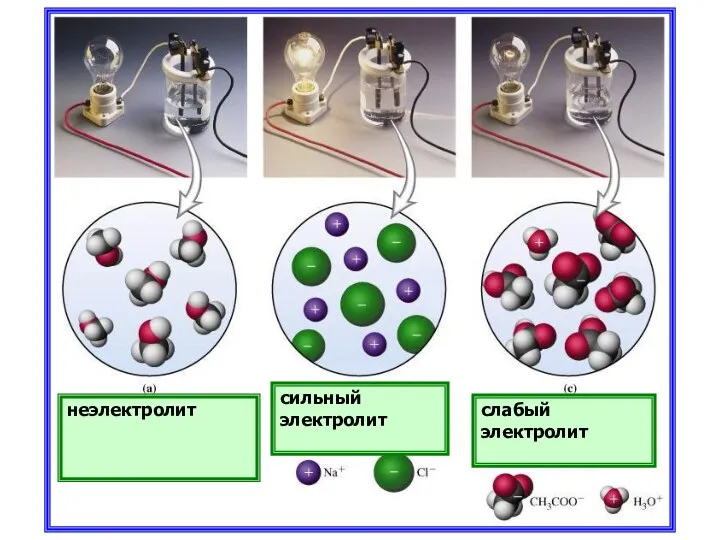
- 8. Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита
- 10. неэлектролит сильный электролит слабый электролит
- 14. Скачать презентацию







 Оборудование тепловых пунктов
Оборудование тепловых пунктов Проектно-исследовательская работа Технология 3 D
Проектно-исследовательская работа Технология 3 D Стили в архитектуре и их особенности. 8 класс
Стили в архитектуре и их особенности. 8 класс Principiile tratamentului în Diabetul Zaharat
Principiile tratamentului în Diabetul Zaharat ЭХОКГ в пульмонологии
ЭХОКГ в пульмонологии Презентация Технология уровневой дифференциации
Презентация Технология уровневой дифференциации Автоматизированные Информационные Системы для государственных, муниципальных заказчиков и бизнеса
Автоматизированные Информационные Системы для государственных, муниципальных заказчиков и бизнеса Человек и пространство. Пейзаж
Человек и пространство. Пейзаж Презентация к классному часу Прощай, 2 класс!
Презентация к классному часу Прощай, 2 класс! Улучшенная штукатурка. Ковровая мозаика
Улучшенная штукатурка. Ковровая мозаика Спортсмены-паралимпийцы Оренбургской области
Спортсмены-паралимпийцы Оренбургской области Европа и наполеоновские войны
Европа и наполеоновские войны Специальный инвестиционный контракт как новый инструмент промышленной политики
Специальный инвестиционный контракт как новый инструмент промышленной политики Дорожные знаки
Дорожные знаки Крупнейшие корпорации Австралии
Крупнейшие корпорации Австралии История компьютеров. Классификация компьютеров. Тенденции развития компьютеров
История компьютеров. Классификация компьютеров. Тенденции развития компьютеров Основы программирования. Простые алгоритмы поиска и сортировки
Основы программирования. Простые алгоритмы поиска и сортировки Измельчительно-режущее оборудование
Измельчительно-режущее оборудование Решение линейных неравенств и систем неравенств
Решение линейных неравенств и систем неравенств Молодежные субкультуры
Молодежные субкультуры Моделируя себя – моделируешь мир
Моделируя себя – моделируешь мир sohrani_moyu_i_svoyu_zhizn
sohrani_moyu_i_svoyu_zhizn Веб-технологии в промышленности и образовании
Веб-технологии в промышленности и образовании Проект Фомина А. МАОУ СШ № 51
Проект Фомина А. МАОУ СШ № 51 Чрезвычайные ситуации и их характеристика. Основные понятия и определения
Чрезвычайные ситуации и их характеристика. Основные понятия и определения Медицинская генетика
Медицинская генетика Вопросы, начинающиеся с Where
Вопросы, начинающиеся с Where Коррекционно-развивающие программы, методики и технологии работы с детьми раннего возраста
Коррекционно-развивающие программы, методики и технологии работы с детьми раннего возраста