Содержание
- 2. Скорость химических реакций - Это изменение концентрации одного из реагирующих или одного из продуктов реакции в
- 3. Химические реакции Гомогенные - реагирующие вещества и продукты реакции находятся в одной фазе 2SO2 (г) +
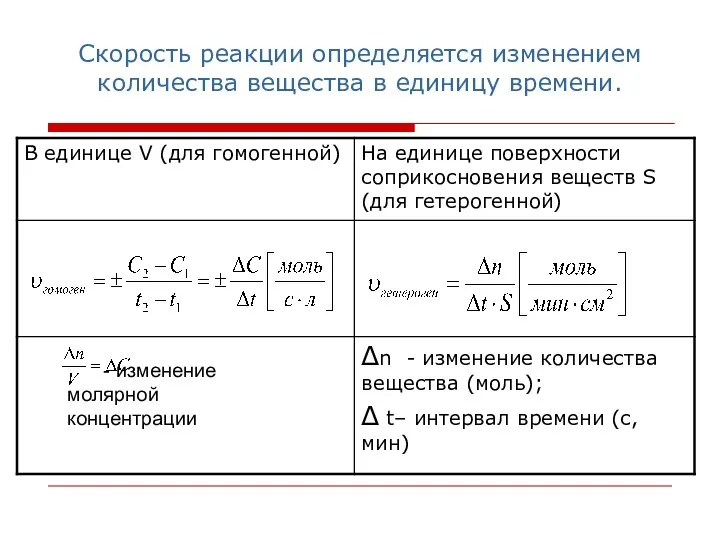
- 4. Скорость реакции определяется изменением количества вещества в единицу времени. - изменение молярной концентрации
- 5. Задача на применение знаний по «Скорости химических реакций» Химическая реакция протекает в растворе, согласно уравнению: А+В
- 6. Самопроверка.
- 7. Задача на применение знаний по «Скорости химических реакций» В некоторый момент времени концентрация хлора Cl2 в
- 8. Самопроверка.
- 9. Факторы, влияющие на скорость химической реакции природа реагирующих веществ; температура; концентрация реагирующих веществ; действие катализаторов; поверхность
- 10. Теория столкновений. Основная идея её такова: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
- 11. 1. Природа реагирующих веществ. Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в
- 12. Задание на применение знаний Объясните разную скорость взаимодействия цинка и магния с уксусной кислотой; цинка с
- 13. 2. Температура При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~
- 14. Задача на применение знаний: Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10°
- 15. Самопроверка а) подставить данные задачи в формулу: скорость реакции увеличится в 81 раз. б) Скорость реакции
- 16. 3. Концентрации реагирующих веществ. На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг,
- 17. Математическое выражение закона действующих масс. По закону действующих масс скорость реакции, уравнение которой А+В=С может быть
- 18. Задача на применение знаний: Составьте кинетические уравнения для следующих реакций: А) H2+I2=2HI Б) S + O2
- 19. Задача на применение знаний: Как изменится скорость реакции, имеющей кинетическое уравнение v= kCA2 CB, если: а)
- 20. Самопроверка. Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций. скорость реакции увеличится в 9
- 21. 4. Действие катализатора Обсуждение вопросов: 1.Что такое катализатор и каталитические реакции? 2. Приведите примеры известных вам
- 22. 5.Поверхность соприкосновения реагирующих веществ. Скорость реакции увеличивается благодаря: -увеличению площади поверхности соприкосновения реагентов (измельчение); -повышению реакционной
- 23. Домашнее задание п. 15, упр. 11, с. 136
- 25. Скачать презентацию





















 Төл создіц тыныс белгілері
Төл создіц тыныс белгілері Презентация на тему Чей голос?
Презентация на тему Чей голос? Diplom
Diplom Проектирование локальной вычислительной сети с доступом в сеть интернет
Проектирование локальной вычислительной сети с доступом в сеть интернет ВКР: Разработка системы управления технологическим процессом ректификации изобутанизобутиленовой фракции
ВКР: Разработка системы управления технологическим процессом ректификации изобутанизобутиленовой фракции Эксплуатация, обслуживание и ремонт общего имущества 5 этажного, 68-квартирного жилого дома в условиях г. Глазова
Эксплуатация, обслуживание и ремонт общего имущества 5 этажного, 68-квартирного жилого дома в условиях г. Глазова Алгоритм поиска погибших неизвестных воинов с использованием информационных сайтов
Алгоритм поиска погибших неизвестных воинов с использованием информационных сайтов Габдулла Кариев
Габдулла Кариев Снятие психоэмоционального напряжения у детей старшего дошкольного возраста.
Снятие психоэмоционального напряжения у детей старшего дошкольного возраста. Организация работы холодного цеха на предпприятии общественного питания
Организация работы холодного цеха на предпприятии общественного питания Концепция структуры и содержания образования по физической культуре в школе
Концепция структуры и содержания образования по физической культуре в школе Ведущие причины смерти и их профилактика с помощью ЗОЖ
Ведущие причины смерти и их профилактика с помощью ЗОЖ Звезды в жизни человека
Звезды в жизни человека Физиология и патология фетоплацентарной системы
Физиология и патология фетоплацентарной системы Лэпбук и его значение в работе с детьми дошкольного возраста
Лэпбук и его значение в работе с детьми дошкольного возраста Условия предоставления займа Антикризисная поддержка
Условия предоставления займа Антикризисная поддержка Работа социального педагога по профилактике ПАВ в условиях общеобразовательной школы
Работа социального педагога по профилактике ПАВ в условиях общеобразовательной школы Разработка технологического процесса капитального ремонта коробки подач токарноревольверного станка модели 1341
Разработка технологического процесса капитального ремонта коробки подач токарноревольверного станка модели 1341 Интеллектуальный турнир. Ломоносовские игры
Интеллектуальный турнир. Ломоносовские игры Толпа. Действия в случае давки
Толпа. Действия в случае давки eng (1)
eng (1) Конструирование оптико-электронных приборов
Конструирование оптико-электронных приборов Социальные иституты
Социальные иституты Синдром дефицита внимания и гиперактивность
Синдром дефицита внимания и гиперактивность Оценка воздействия на окружающую среду при расширении/строительстве канализационной сети в городе Каракол
Оценка воздействия на окружающую среду при расширении/строительстве канализационной сети в городе Каракол Буквы о, а на конце наречий с приставками из, до,с, за, на, в. 7 класс
Буквы о, а на конце наречий с приставками из, до,с, за, на, в. 7 класс Женские образы в произведениях изобразительного искусства России
Женские образы в произведениях изобразительного искусства России Фото на память
Фото на память