Содержание
- 2. Цель урока: Изучить состав, строение и номенклатуру солей.
- 3. Дайте названия следующим веществам и распределите их по классам неорганических соединений: HCl P2O5 Ва(OH)2 Актуализация знаний.
- 4. Определить какая из формул представленных на слайде лишняя: HNO3 H2SO4 N2O5
- 5. Новая тема урока
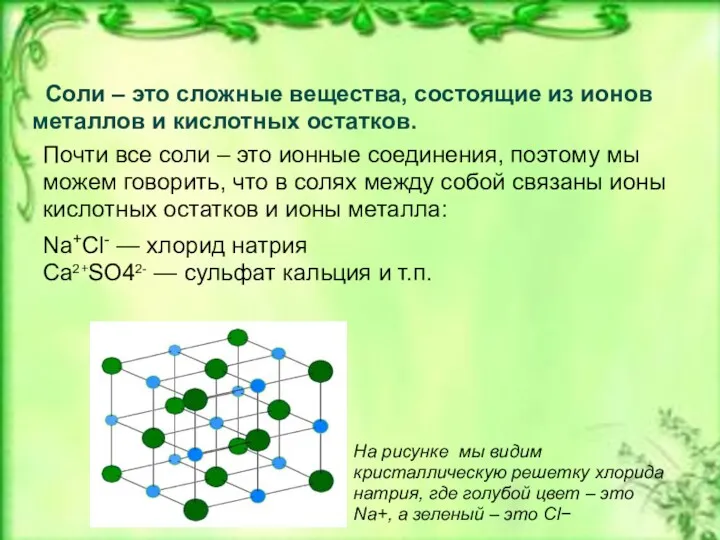
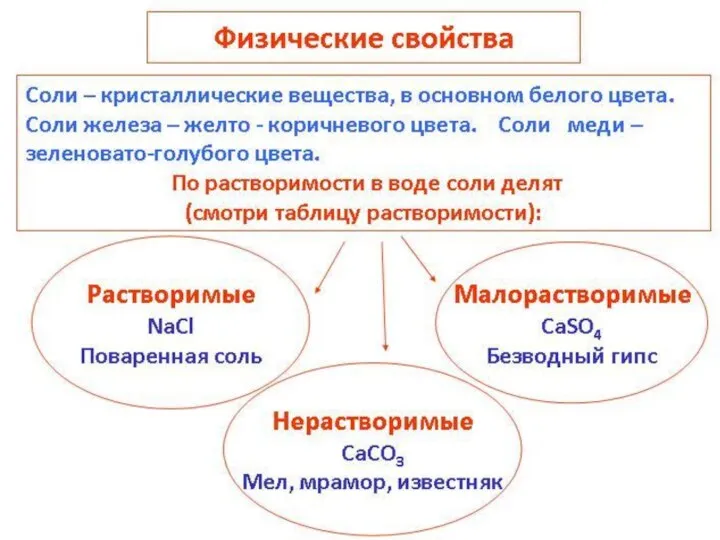
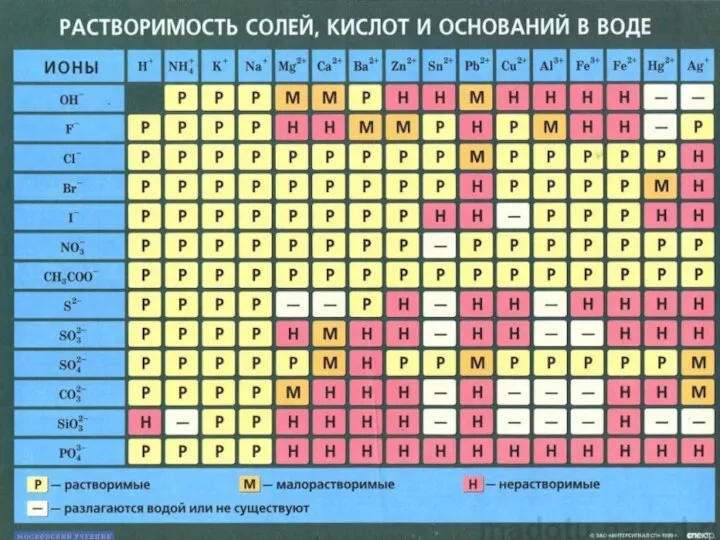
- 6. Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Почти все соли –
- 8. Составление формул солей Записать химический знак металла и кислотного остатка, входящих в состав соли. Подставить степени
- 9. Составление названий солей Название кислотных остатков кислородсодержащих кислот, как правило, имеют окончания - ат. Al2 (SO4)3
- 10. Назовите соли: MgSO4 Fe(NO3)3 CaCO3 NaF
- 13. СОЛИ В ПРИРОДЕ
- 14. Эльтон — солёное озеро
- 16. Карбонат кальция в природе
- 17. Карбонат кальция CaCO3, нерастворимый в воде, – важнейшая соль, из которой многочисленные морские животные: моллюски, раки,
- 20. Скачать презентацию














 Тема урока Углерод. 9 класс.
Тема урока Углерод. 9 класс. Организация режима дня школьника
Организация режима дня школьника Федор Абрамов. Приглашение к прочтению
Федор Абрамов. Приглашение к прочтению Портфоліо Майстра виробничого навчання
Портфоліо Майстра виробничого навчання Эргономика спальной комнаты.Автоподъемник кровати
Эргономика спальной комнаты.Автоподъемник кровати Методика преподавания дисциплин информационного цикла. Контроль и оценка знаний. Часть 2
Методика преподавания дисциплин информационного цикла. Контроль и оценка знаний. Часть 2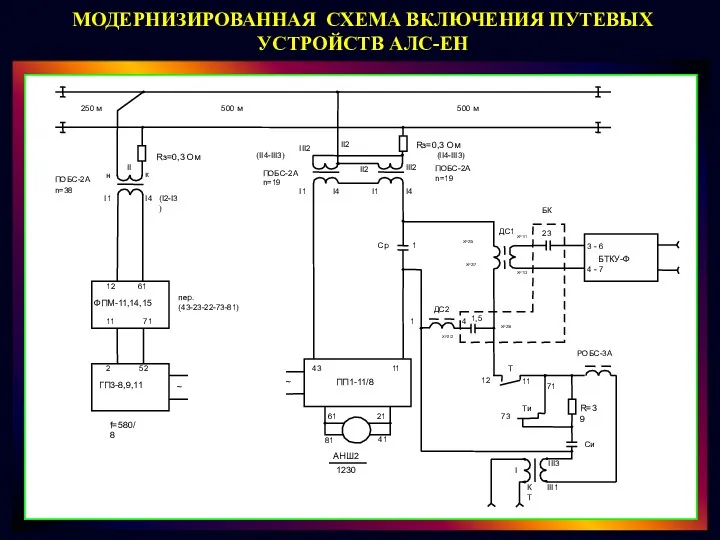 Модернизированная схема включения путевых устройств АЛС-ЕН
Модернизированная схема включения путевых устройств АЛС-ЕН Театрализованная деятельность как средство коррекции речевых нарушений
Театрализованная деятельность как средство коррекции речевых нарушений Ваш ребёнок идёт в школу
Ваш ребёнок идёт в школу Опорно-двигательный аппарат. Скелет человека
Опорно-двигательный аппарат. Скелет человека Помним. Гордимся. От военного времени до настоящего...
Помним. Гордимся. От военного времени до настоящего... Анализ оборотных средств организации и эффективности их использования ОАО Полоцк-Стекловолокно
Анализ оборотных средств организации и эффективности их использования ОАО Полоцк-Стекловолокно 20191026_prezentatsiya_voyna_glazami_detey
20191026_prezentatsiya_voyna_glazami_detey Модель сетевого взаимодействия МОУ в образовательном округе
Модель сетевого взаимодействия МОУ в образовательном округе CAE Speaking Practice
CAE Speaking Practice Методы формирования физической культуры личности
Методы формирования физической культуры личности Рубромикоз. Рубромикоз қоздырғышы
Рубромикоз. Рубромикоз қоздырғышы Значение и свойства воды
Значение и свойства воды Сюжетно - ролевая игра как средство взаимоотношений детей старшего дошкольного возраста.
Сюжетно - ролевая игра как средство взаимоотношений детей старшего дошкольного возраста. Биография и творчество Александра Трифоновича Твардовского
Биография и творчество Александра Трифоновича Твардовского Презентация Капля море бережет
Презентация Капля море бережет Электромеханические элементы релейной защиты
Электромеханические элементы релейной защиты Введение в раздел дисциплины. Нормативные требования к аэродромным сооружениям
Введение в раздел дисциплины. Нормативные требования к аэродромным сооружениям phphKIQ2I_Prezentaciya1
phphKIQ2I_Prezentaciya1 Структура урока системно-деятельностного подхода в обучении.
Структура урока системно-деятельностного подхода в обучении. История Древнего мира, 5 класс
История Древнего мира, 5 класс Основы тепловой обработки пищевых продуктов
Основы тепловой обработки пищевых продуктов Памятные места Отечественной войны 1812 года в Санкт-Петербурге
Памятные места Отечественной войны 1812 года в Санкт-Петербурге