Содержание
- 2. Для этого необходимо выполнить составить уравнения реакций в молекулярном виде Определить степень окисления элементов В реакциях,
- 3. Составим молекулярные уравнения реакций 2Cu + O2 ? 2CuO CuO + 2HCl ? CuCl2 + H2O
- 4. Определим степень окисления элементов 2Cu0 + O20? 2Cu+2O-2 Cu +2 O-2 + 2H+Cl- ? Cu+2Cl2-1 +
- 5. Степень окисления элементов изменилась только в первой реакции 2Cu0 + O20? 2Cu+2O-2 Определим переход электронов Найдем
- 6. Оформляем окислительно-восстановительную реакцию 2Cu0 + O20? 2Cu+2O-2 Cu0 – 2e ?Cu+2 O20 + 4e ?2O-2 4
- 7. Составляем полные ионные уравнения CuO + 2H+ + 2Сl - ? Cu+2 + 2Cl - +
- 8. Составляем краткие ионные уравнения CuO + 2H+ ?Cu+2 + H2O Cu+2 + 2OH - ? Cu(OH)2
- 10. Скачать презентацию







 Выбор конфигурации компьютера
Выбор конфигурации компьютера Психологические особенности детей подросткового возраста
Психологические особенности детей подросткового возраста Пожарная безопасность
Пожарная безопасность Творчий проект Переборні задачі Паскаль
Творчий проект Переборні задачі Паскаль Изоляторы
Изоляторы С 8 марта поздравляем
С 8 марта поздравляем Лазерные технологии в амбулаторной оториноларингологии
Лазерные технологии в амбулаторной оториноларингологии Кітап оқуға баулу
Кітап оқуға баулу Исследование функции на монотонность и экстремумы
Исследование функции на монотонность и экстремумы Імпресіонізм
Імпресіонізм Фотоальбом группы Весёлые зайчата
Фотоальбом группы Весёлые зайчата кто нас защищает_ ПОЛИЦИЯ
кто нас защищает_ ПОЛИЦИЯ ПрезентацияНарушение прав человека
ПрезентацияНарушение прав человека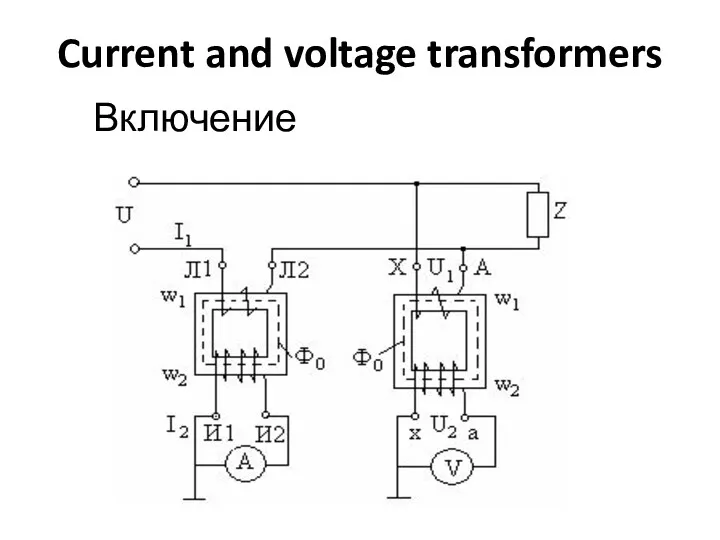 Current and voltage transformers
Current and voltage transformers Объёмы прямоугольного параллелепипеда и куба
Объёмы прямоугольного параллелепипеда и куба Знакомимся с великими пирамидами
Знакомимся с великими пирамидами Создание кроссворда средствами Microsoft Word
Создание кроссворда средствами Microsoft Word Патогенез себореи (акне)
Патогенез себореи (акне) Приемы и техники массажа. Движение
Приемы и техники массажа. Движение Даниил Гранин
Даниил Гранин Семь законов обучения. То что нужно знать учителю о своем служении
Семь законов обучения. То что нужно знать учителю о своем служении Растениеводство. Кормовые однолетние и многолетние культуры
Растениеводство. Кормовые однолетние и многолетние культуры Чрезвычайные ситуации природного и техногенного характера. Причины и возможные последствия их возникновения
Чрезвычайные ситуации природного и техногенного характера. Причины и возможные последствия их возникновения Агропромышленный комплекс России
Агропромышленный комплекс России Первое родительское собрание в 1 классе
Первое родительское собрание в 1 классе Внешний вид курильщика
Внешний вид курильщика Мостай Кәрим Урманда, 3 класс, дәрес планы
Мостай Кәрим Урманда, 3 класс, дәрес планы Условные знаки в спортивном ориентировании
Условные знаки в спортивном ориентировании