Применение аутологичной плазмы в комплексном лечении нарушений репродуктивного здоровья у женщин презентация
Содержание
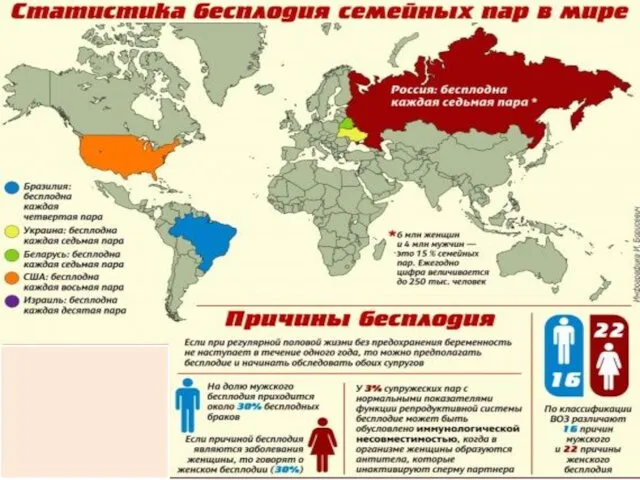
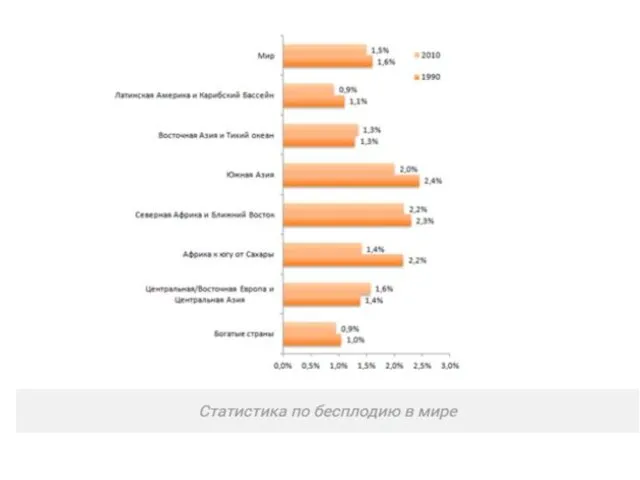
- 3. Проблема бесплодного брака в течении последних десятилетий находится в центре внимания гинекологов, репродуктологов и специалистов смежных
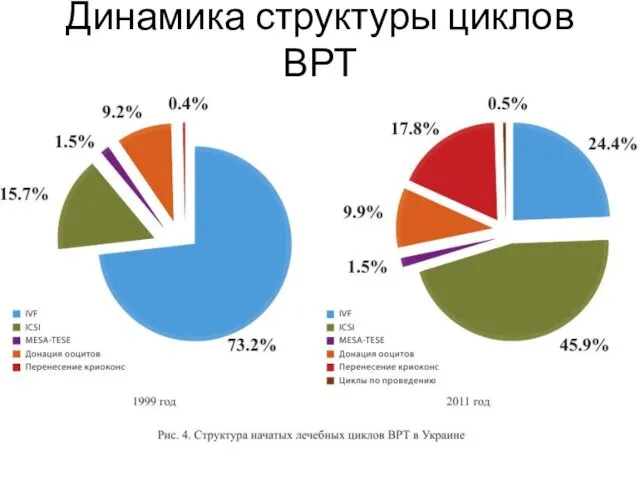
- 4. Динамика структуры циклов ВРТ
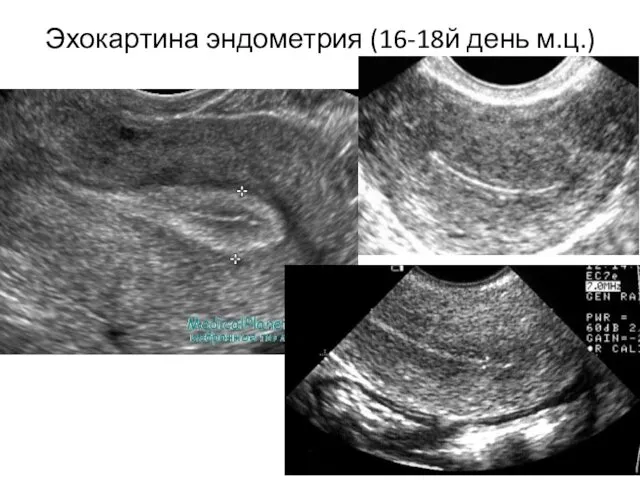
- 5. Эхокартина эндометрия (16-18й день м.ц.)
- 7. Тромбоциты являются участниками сложного процесса взаимодействия форменных элементов крови [3]. Имеющиеся научные данные позволяют сделать вывод
- 8. 2003 г. Российский врач и исследователь Р. Р. Ахмеров применил аутологичную плазму для лечения воспалительных заболеваний
- 9. Роль тромбоцитов Результаты попыток выделить какие-либо звенья клеточных и других реакций спорны и не имеют подтверждения
- 10. В чем заключается терапия плазмой аутологичной крови? Терапия плазмой аутологичной крови предполагает введение нативной плазмы в
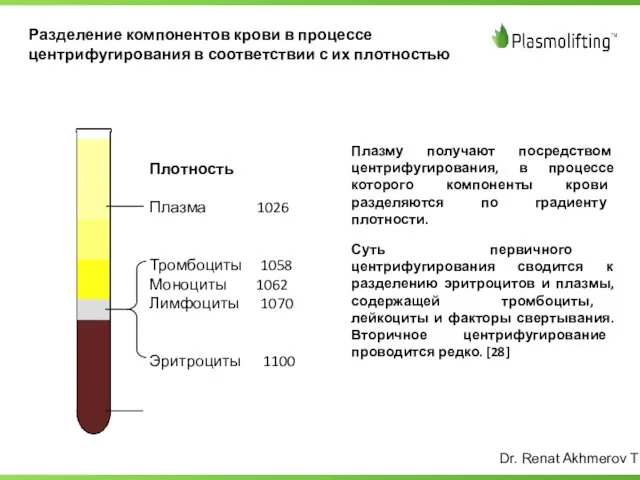
- 11. Разделение компонентов крови в процессе центрифугирования в соответствии с их плотностью Плазму получают посредством центрифугирования, в
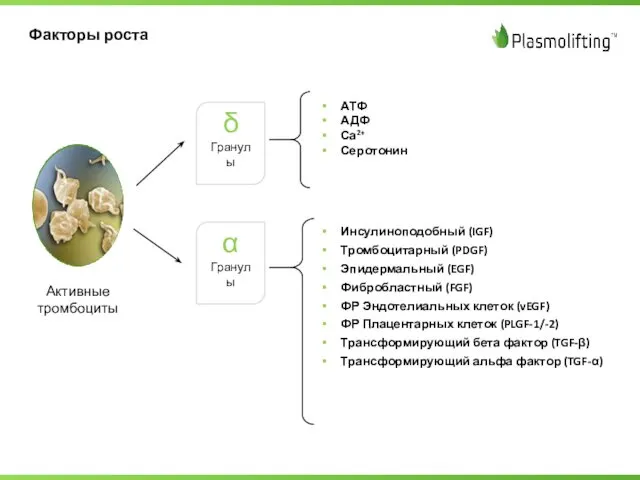
- 12. Активные тромбоциты δ Гранулы АТФ АДФ Са2+ Серотонин Инсулиноподобный (IGF) Тромбоцитарный (PDGF) Эпидермальный (EGF) Фибробластный (FGF)
- 13. Целью исследования было повышение эффективности лечения бесплодия у женщин путем включения в комплекс лечебных мероприятий терапии
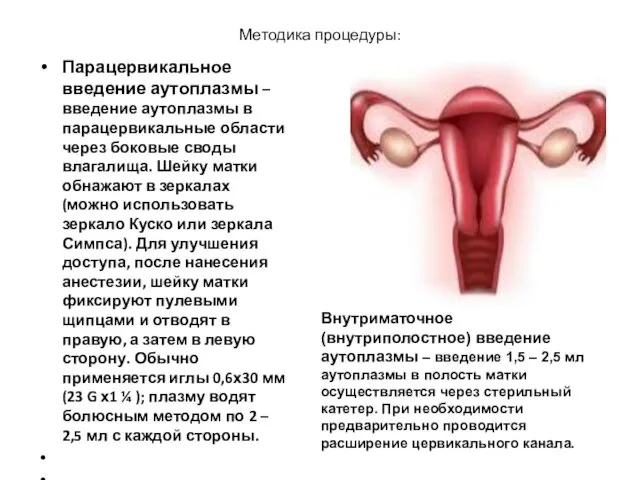
- 14. Методика процедуры: Парацервикальное введение аутоплазмы – введение аутоплазмы в парацервикальные области через боковые своды влагалища. Шейку
- 15. Разработанная методика У пациентки забирали 8 мл венозной крови в специальную пробирку Plasmolifting™, которую центрифугировали при
- 16. Результаты и обсуждение: При планировании цикла стимуляции оценивали основные клинико-гормональные показатели обследованных женщин: Фолликулстимулирующий гормон (ФСГ),
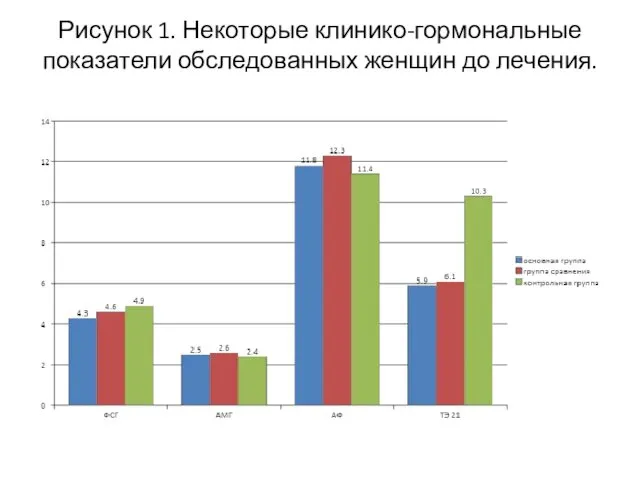
- 17. Рисунок 1. Некоторые клинико-гормональные показатели обследованных женщин до лечения.
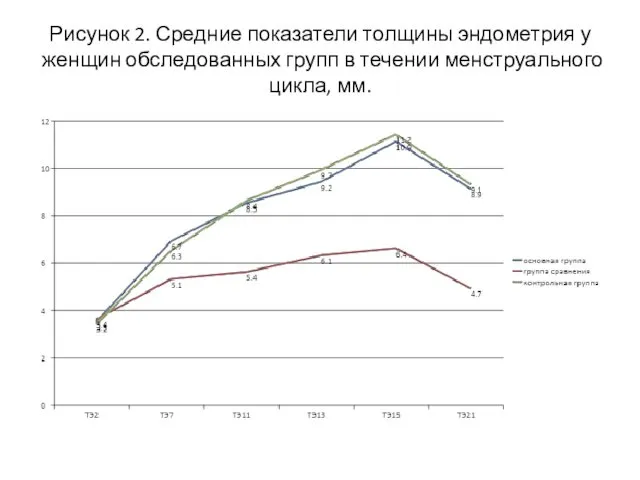
- 18. Рисунок 2. Средние показатели толщины эндометрия у женщин обследованных групп в течении менструального цикла, мм.
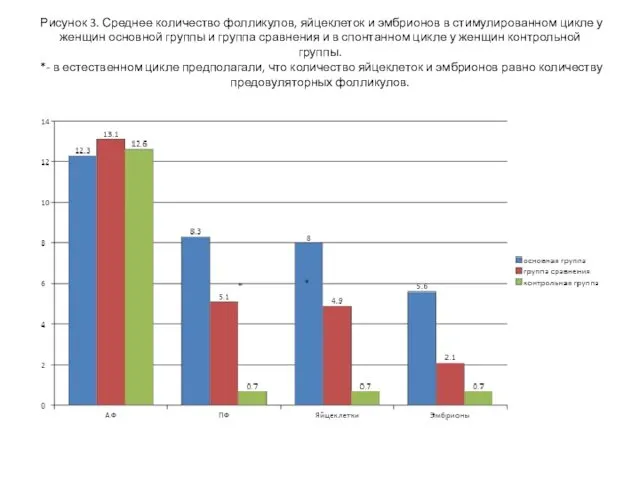
- 19. Рисунок 3. Среднее количество фолликулов, яйцеклеток и эмбрионов в стимулированном цикле у женщин основной группы и
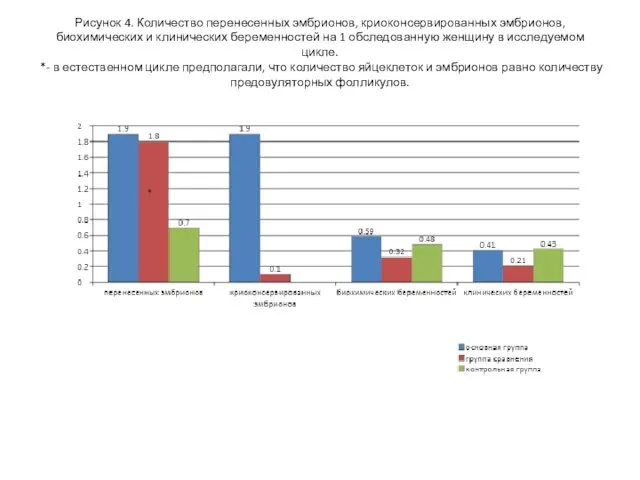
- 20. Рисунок 4. Количество перенесенных эмбрионов, криоконсервированных эмбрионов, биохимических и клинических беременностей на 1 обследованную женщину в
- 21. Выводы: терапия аутологичной плазмой, приготовленной с использованием пробирок PlasmoliftingTM, позволяет повысить эффективность лечения бесплодия методом ЭКО
- 22. В 2016 году представлены результаты нашего исследования применения технологии Плазмолифтинг в лечении бесплодия методами ВРТ
- 23. Методические рекомендации размещены на сайте www.plasmolifting.ru
- 25. Скачать презентацию

![Тромбоциты являются участниками сложного процесса взаимодействия форменных элементов крови [3].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/77729/slide-6.jpg)









 Первые постройки Санкт-Петербурга. Петропавловская крепость
Первые постройки Санкт-Петербурга. Петропавловская крепость Искусственній интеллект: фантастика или реальность?
Искусственній интеллект: фантастика или реальность? Жизнь под угрозой.
Жизнь под угрозой. Чёрная металлургия. Факторы размещения предприятий чёрной металлургии
Чёрная металлургия. Факторы размещения предприятий чёрной металлургии Non-equivalent vocabulary
Non-equivalent vocabulary Формы взаимодействия психолога с коллективом
Формы взаимодействия психолога с коллективом Презентация П.И.Чайковский
Презентация П.И.Чайковский Топливно-энергетический комплекс (ТЭК), его значение и проблемы
Топливно-энергетический комплекс (ТЭК), его значение и проблемы Школа Тимофей. Киев
Школа Тимофей. Киев Лечебно-профилактическое питание
Лечебно-профилактическое питание Конкурс Серебрянная звезда, участник Королёва Лидия
Конкурс Серебрянная звезда, участник Королёва Лидия Электроподвижной состав
Электроподвижной состав Буклет для родителей Информационная безопасность детей в Интернете
Буклет для родителей Информационная безопасность детей в Интернете Изоляторы
Изоляторы Вадбольская Георгиевская (Егорьева) мужская пустынь
Вадбольская Георгиевская (Егорьева) мужская пустынь Физическая активность – путь к здоровью
Физическая активность – путь к здоровью Урок на тему Отмена крепостного права 1861 года.
Урок на тему Отмена крепостного права 1861 года. Бизнес-инкубаторы и инновация
Бизнес-инкубаторы и инновация Вводная часть (классификация строительных материалов и их свойств, основные свойства строительных материалов)
Вводная часть (классификация строительных материалов и их свойств, основные свойства строительных материалов) Герои Геленджика. Улицы, названные в честь героев Геленджика. Памятники Геленджика
Герои Геленджика. Улицы, названные в честь героев Геленджика. Памятники Геленджика Нормативна грошова оцінка земель населених пунктів
Нормативна грошова оцінка земель населених пунктів Электронный регистр диспансерных больных
Электронный регистр диспансерных больных Фотопутешествие по залам Мордовского музея изобразительных искусств им. Эрьзи
Фотопутешествие по залам Мордовского музея изобразительных искусств им. Эрьзи Лекция Системы сбора и обработки информации (ССОИ)
Лекция Системы сбора и обработки информации (ССОИ) Астраханская духовная семинария и ее пермские и астраханские ректоры
Астраханская духовная семинария и ее пермские и астраханские ректоры Сименс. Паровые турбины - оборудование и услуги
Сименс. Паровые турбины - оборудование и услуги Презентация Дети блокадного Ленинграда
Презентация Дети блокадного Ленинграда Детская агрессивность и её причины. Пути коррекции поведения детей.
Детская агрессивность и её причины. Пути коррекции поведения детей.