Содержание
- 2. Лазерная диагностика Задача диагностики – достоверное извлечение информации о состоянии организма и патологических изменений в нём.
- 3. Принципы лазерной диагностики Методы лазерной диагностики можно разделить на: Микродиагностические (на уровне атомов и молекул) –
- 4. Лазерная захватывающая микродиссекция (ЛМЗ) как пример разрушающего действия лазера в диагностике — метод изоляции отдельных клеток
- 5. В коммерческих системах для лазерной микродиссекции используются, как правило, следующие лазеры: азотный лазер (337 нм), а
- 6. Использование лазерного луча, сфокусированного объективом микроскопа, в качестве «режущего» инструмента позволяет выделять объекты интереса микроскопических размеров
- 7. Лазерная макродиагностика В основе – использование высокой монохроматичности и когерентности лазерного излучения, которая позволяет измерять положение,
- 8. Голография и интерферометрия Голографические методы позволяют получать трехмерные изображения биообъекта, контуры объекта могут быть картированы, а
- 9. Флуориметрия Лазер как источник излучения (возбуждающего флуоресценцию) очень часто используется в ходе флуоресцентного анализа, например: 1.
- 10. ПРИМЕНЕНИЕ ЛАЗЕРОВ В ДИАГНОСТИКЕ (спектры собственной флуоресценции) Спектры флуоресценции от почки (а) и предстательной железы (б)
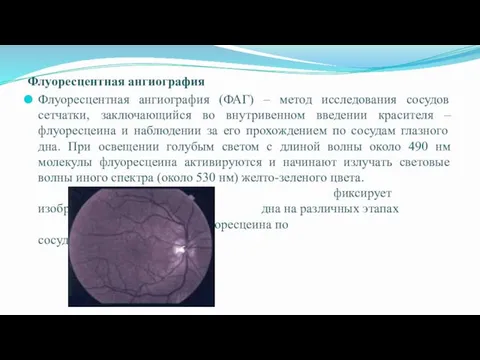
- 12. Флуоресцентная ангиография Флуоресцентная ангиография (ФАГ) – метод исследования сосудов сетчатки, заключающийся во внутривенном введении красителя –
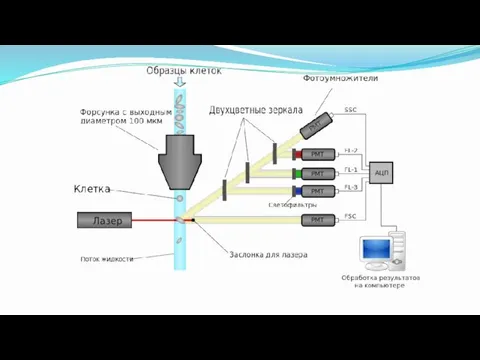
- 17. Принцип получения информации Клеточная суспензия, предварительно меченная флуоресцирующими моноклональными антителами или флуоресцентными красителями, попадает в поток
- 18. Преимущества короткое время анализа (сек) за счет высокой скорости анализ большого количества клеток (до 108 клеток)
- 19. Лазерная пролётная цитометрия с многопараметрическим подходом, основанным на светорассеянии (например,He-Ne лазер 633 нм) , иногда в
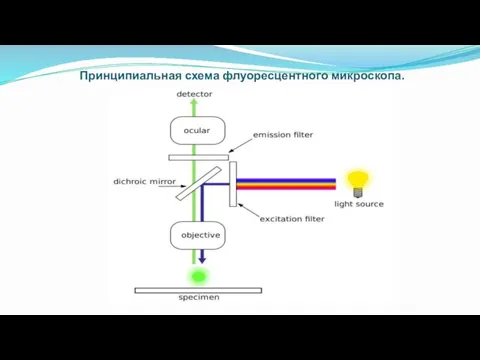
- 21. Принципиальная схема флуоресцентного микроскопа.
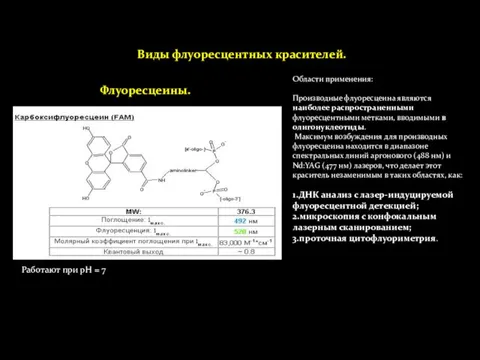
- 22. Виды флуоресцентных красителей. Флуоресцеины. Области применения: Производные флуоресцеина являются наиболее распространенными флуоресцентными метками, вводимыми в олигонуклеотиды.
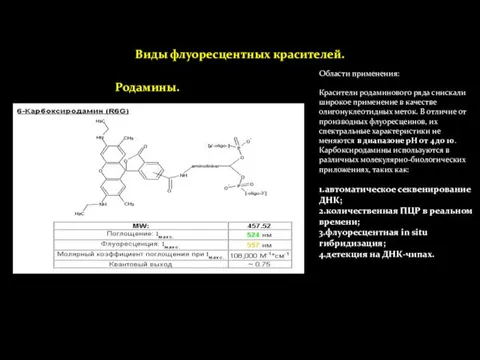
- 23. Виды флуоресцентных красителей. Области применения: Красители родаминового ряда снискали широкое применение в качестве олигонуклеотидных меток. В
- 24. Виды флуоресцентных красителей. Родамины. Карбокси-Х-родамин (ROX) Тетраметилкарбоксиродамин (TAMRA) TAMRA используется прежде всего в качестве акцептора флуоресценции
- 25. Виды флуоресцентных красителей. Гасители флуоресценции. Области применения: Dabsyl используется как гаситель (quencher) флуоресценции флуорофоров с lem
- 26. Конфокальный микроскоп
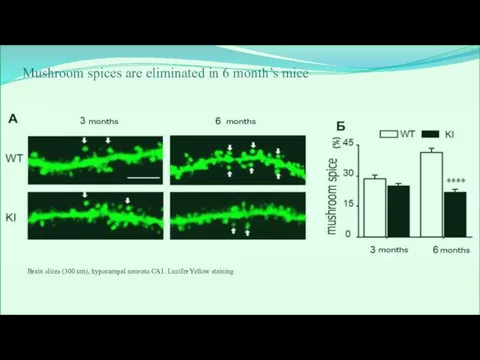
- 27. Mushroom spices are eliminated in 6 month’s mice Brain slices (300 um), hypocampal neurons СА1. Lucifer
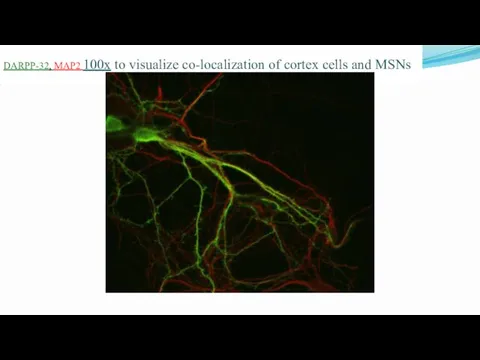
- 28. DARPP-32, MAP2 100х to visualize co-localization of cortex cells and MSNs
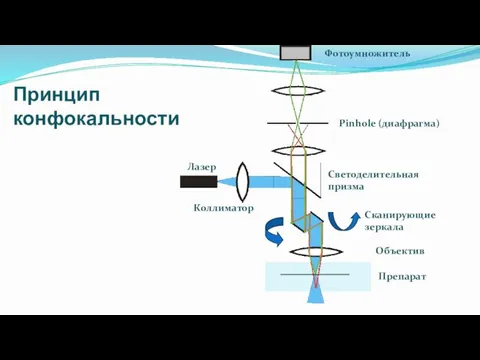
- 29. Лазер Коллиматор Светоделительная призма Объектив Препарат Pinhole (диафрагма) Фотоумножитель Сканирующие зеркала Принцип конфокальности
- 30. Что значит «конфокальный»? Конфокальный микроскоп отличается от "классического" оптического микроскопа тем, что в каждый момент времени
- 31. Вторая особенность состоит в том, что осветитель создает не равномерную освещенность поля зрения, а фокусирует свет
- 32. Альтернативой является использование светоделительной пластинки. Схема со светоделительной пластинкой упрощает конструкцию микроскопа за счет двойного использования
- 33. Сканирование проходит слоями
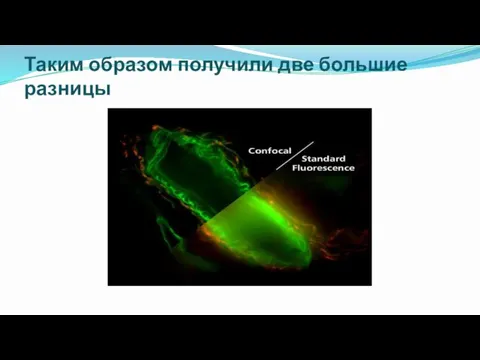
- 34. Таким образом получили две большие разницы
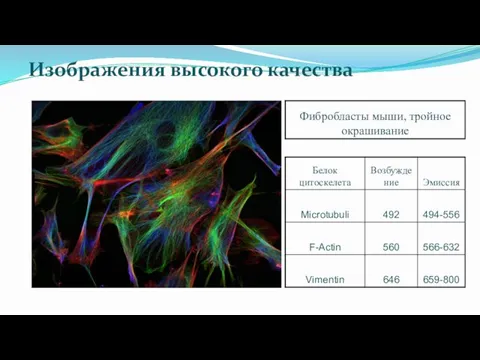
- 35. Изображения высокого качества
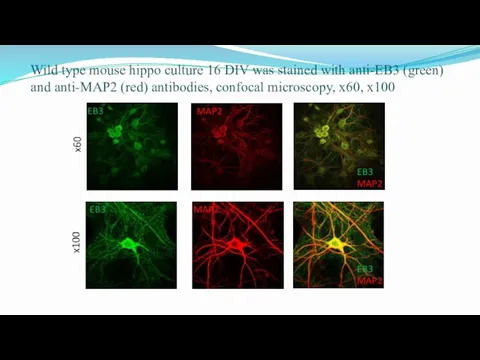
- 36. Wild type mouse hippo culture 16 DIV was stained with anti-EB3 (green) and anti-MAP2 (red) antibodies,
- 39. Сенсибилизаторы второго поколения на основе хлорофилла а Флуоресцентная диагностика раковых опухолей
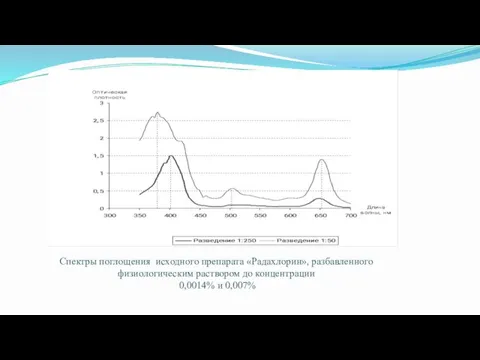
- 40. Спектры поглощения исходного препарата «Радахлорин», разбавленного физиологическим раствором до концентрации 0,0014% и 0,007%
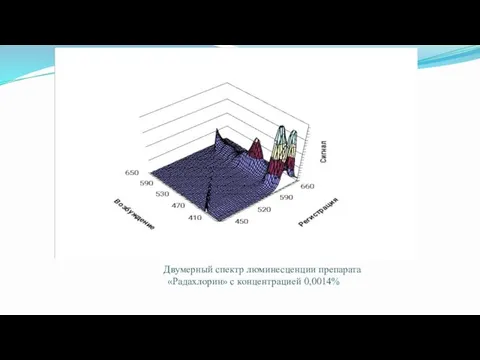
- 41. Двумерный спектр люминесценции препарата «Радахлорин» с концентрацией 0,0014%
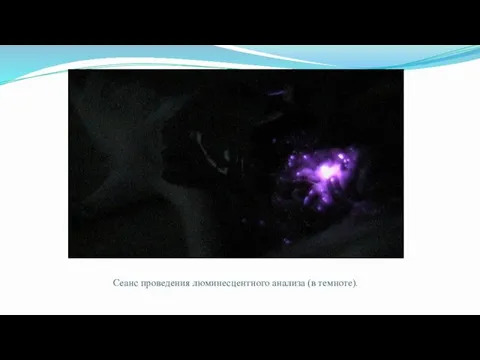
- 43. Рис.5 Наглядное представление о проведении сеанса
- 44. Сеанс проведения люминесцентного анализа (в темноте).
- 45. Оптическая когерентная томография(ОКТ)- 1)это метод медицинского имиджинга, позволяющий получать изображения приповерхностных тканей организма человека in vivo
- 46. Биологические ткани являются прекрасным объектом для оптической томографии в диапазоне длин волн так называемого терапевтического окна
- 47. Что изучает ОКТ? кожа слизистые оболочки шейки матки пищевода мочевого пузыря желудка тонкого и толстого кишечника
- 48. Все эти ткани имеют общие признаки гистологического строения: поверхностный плоский, переходный или цилиндрический эпителий, базальную мембрану,
- 49. Основными преимуществами ОКТ являются: изображение в реальном времени почти микроскопическое разрешение мгновенная, направленная визуализация не требует
- 50. Физический принцип
- 51. Использование метода ОКТ в видеоэндоскопии.
- 52. Эндоскопический торцевой OКT-микрозонд в биопсийном канале фиброгастроскопа.
- 53. Показания к применению ОКТ детекция патологических изменений, включая раннее обнаружение неоплазии оптимизация прицельной биопсии; дифференциальная диагностика
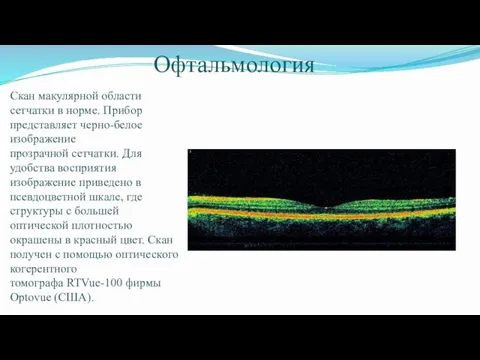
- 54. Офтальмология Скан макулярной области сетчатки в норме. Прибор представляет черно-белое изображение прозрачной сетчатки. Для удобства восприятия
- 55. Трехмерная реконструкция макулярной области сетчатки глаза того же пациента (3 х 3 мм), полученная в результате
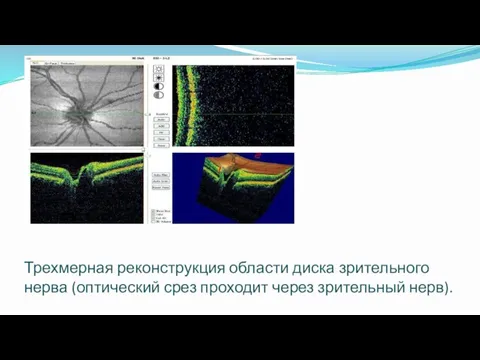
- 56. Трехмерная реконструкция области диска зрительного нерва (оптический срез проходит через зрительный нерв).
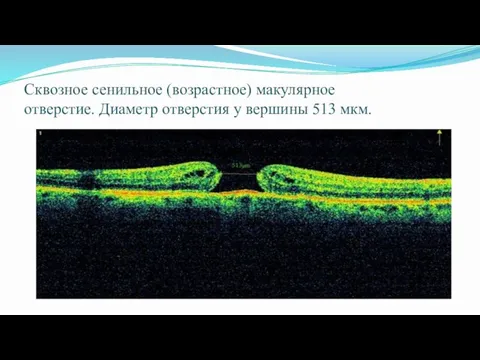
- 57. Сквозное сенильное (возрастное) макулярное отверстие. Диаметр отверстия у вершины 513 мкм.
- 58. Трехмерная реконструкция макулярной области сетчатки того же пациента. Хорошо визуализируются изменения в слоях сетчатки вокруг отверстия.
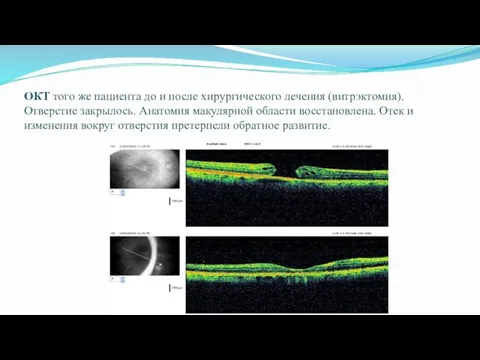
- 59. ОКТ того же пациента до и после хирургического лечения (витрэктомия). Отверстие закрылось. Анатомия макулярной области восстановлена.
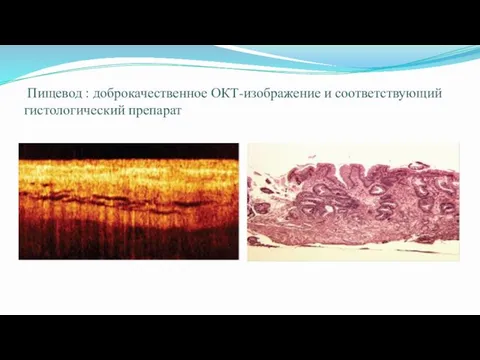
- 60. Пищевод : доброкачественное ОКТ-изображение и соответствующий гистологический препарат
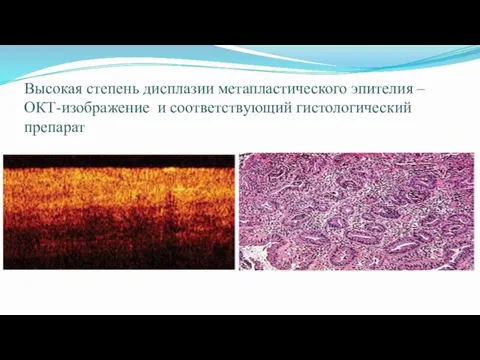
- 61. Высокая степень дисплазии метапластического эпителия – ОКТ-изображение и соответствующий гистологический препарат
- 62. Оптогенетика Метод, объединяющий в себе оптику и генетику Позволяет детектировать приобретение или потерю функций специфических клеток,
- 63. Шаг 1: Вставить гены опсинов в желаемые клетки 1: Controlling the Brain with Light by Karl
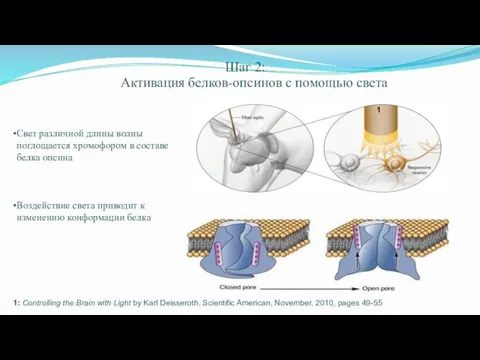
- 64. Шаг 2: Активация белков-опсинов с помощью света 1: Controlling the Brain with Light by Karl Deisseroth,
- 65. Преимущества Направленный контроль активности одного типа клеток при неизменном состоянии других (генетически ориентированные на специфические группы
- 66. Быстрое возбуждение: Каналородопсин Channelrhodopsin2 Свет-активируемый ионный канал изолированный из зеленой водоросли Chlamydomonas reinhardtii Неспецифический катионный канал,
- 67. Халородопсин (Halorhodopsin) Халоропсин (Halorhodopsin) использует оранжевый свет для перемещения хлорид- ионов в клетку, преодолевая мембранный потенциал
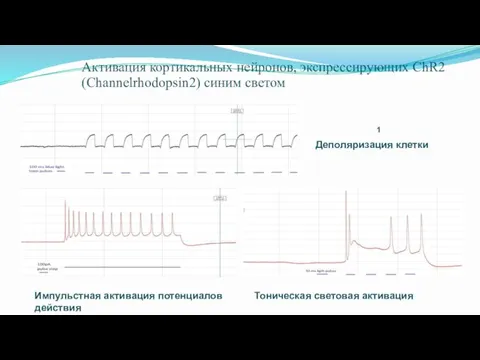
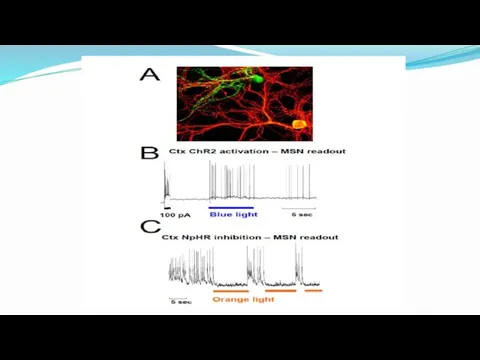
- 68. Активация кортикальных нейронов, экспрессирующих ChR2 (Channelrhodopsin2) синим светом 1 Деполяризация клетки Импульстная активация потенциалов действия Тоническая
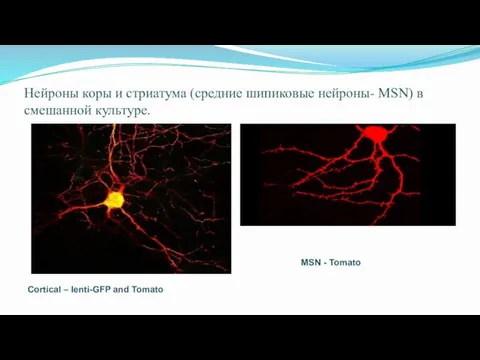
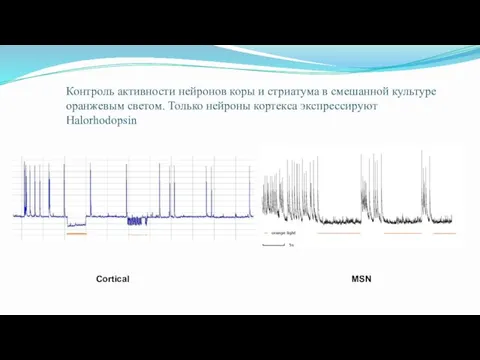
- 69. Нейроны коры и стриатума (средние шипиковые нейроны- MSN) в смешанной культуре. Cortical – lenti-GFP and Tomato
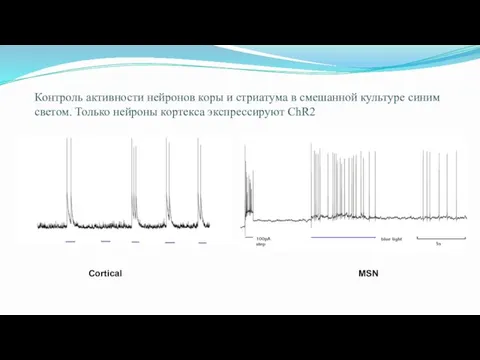
- 70. Контроль активности нейронов коры и стриатума в смешанной культуре синим светом. Только нейроны кортекса экспрессируют ChR2
- 71. Контроль активности нейронов коры и стриатума в смешанной культуре оранжевым светом. Только нейроны кортекса экспрессируют Halorhodopsin
- 73. Испытательная установка (на клеточных культурах нейронов) Общий вид экспериментального комплекса Исследовательские возможности ЛМН
- 74. Будущее оптогенетики Данная разработка позволит увеличить точность позиционирования биоэлектрического датчика и качество съема и обработки экспериментальных
- 75. Разработки в мире 1. 2. Гибкий массив электродов, моделируемый по форме экспериментального образца (Columbia University, USA)
- 77. Скачать презентацию
















































 Уроки качества,1-2 (Кубанское - отличное, Молочные реки)
Уроки качества,1-2 (Кубанское - отличное, Молочные реки) Как животные видят мир
Как животные видят мир 20230626_summa_arifmeticheskoy_progressii
20230626_summa_arifmeticheskoy_progressii Новая система KPI's партнеров Tele 2
Новая система KPI's партнеров Tele 2 23февраля-День защитника Отечества
23февраля-День защитника Отечества Творить и думать каждый рад в Союзе Современных Ребят
Творить и думать каждый рад в Союзе Современных Ребят Управление поставками проекта
Управление поставками проекта Презентация без названия (wecompress.com)
Презентация без названия (wecompress.com) Марія Заньковецька
Марія Заньковецька Электронный каталог – важнейшая часть цифрового контента Национальной библиотеки имени С. Г. Чавайна
Электронный каталог – важнейшая часть цифрового контента Национальной библиотеки имени С. Г. Чавайна Аминокислоты. Белки
Аминокислоты. Белки Презентация реализация ФГОС ДОУ
Презентация реализация ФГОС ДОУ Тұқым қуалайтын аурулардың патогенезі. (Гемафилия)
Тұқым қуалайтын аурулардың патогенезі. (Гемафилия) Экспериментальный этап исследования. Эмпирические методы исследования
Экспериментальный этап исследования. Эмпирические методы исследования Аварии на химически опасных объектах и химическое заражение окружающей среды
Аварии на химически опасных объектах и химическое заражение окружающей среды Общие сведения о приспособлениях
Общие сведения о приспособлениях Прокатные производства, прессование волочения
Прокатные производства, прессование волочения Пирамида. Задания для устного счета. Упражнение 11
Пирамида. Задания для устного счета. Упражнение 11 Методика обучения рассуждению
Методика обучения рассуждению Управление МКД. Цели и задачи
Управление МКД. Цели и задачи Корпоративное венчурные фонды, как новый субъект отношений в сфере интеллектуальной собственности
Корпоративное венчурные фонды, как новый субъект отношений в сфере интеллектуальной собственности Дети и музей
Дети и музей Правильная осанка
Правильная осанка Понятие функции в Excel
Понятие функции в Excel Дошкольный возраст. Возрастная характеристика развития ребенка
Дошкольный возраст. Возрастная характеристика развития ребенка Синхронные машины. Магнитные поля и векторные диаграммы. Характеристики и режимы работы
Синхронные машины. Магнитные поля и векторные диаграммы. Характеристики и режимы работы Мир моих увлечений
Мир моих увлечений Презентация Режим дня
Презентация Режим дня