Содержание
- 2. Содержание Классификация дисперсных систем Основные понятия Концентрация растворов Энергетические эффекты при образовании растворов Растворимость веществ Закон
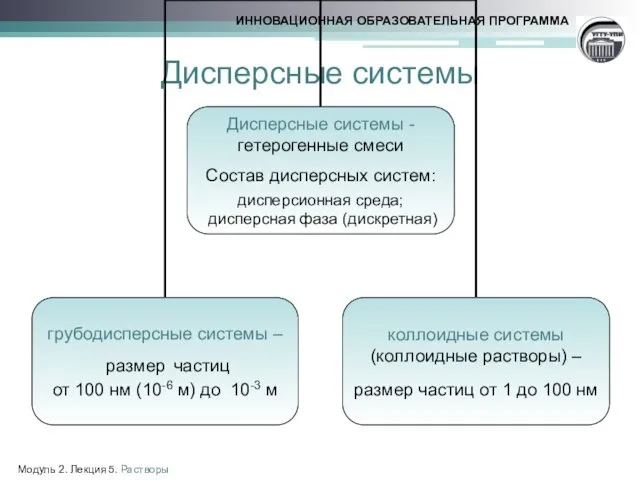
- 3. Дисперсные системы Модуль 2. Лекция 5. Растворы
- 4. Классификация дисперсных систем Модуль 2. Лекция 5. Растворы
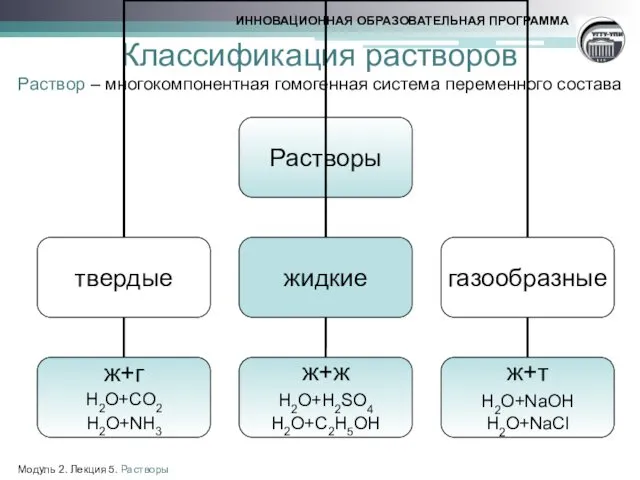
- 5. Классификация растворов Раствор – многокомпонентная гомогенная система переменного состава Модуль 2. Лекция 5. Растворы
- 6. Способы выражения концентрации Массовая доля вещества – отношение массы растворенного вещества (mB) к массе раствора (mp)
- 7. Способы выражения концентрации Молярная доля вещества В – отношение количества вещества В к общему количеству веществ,
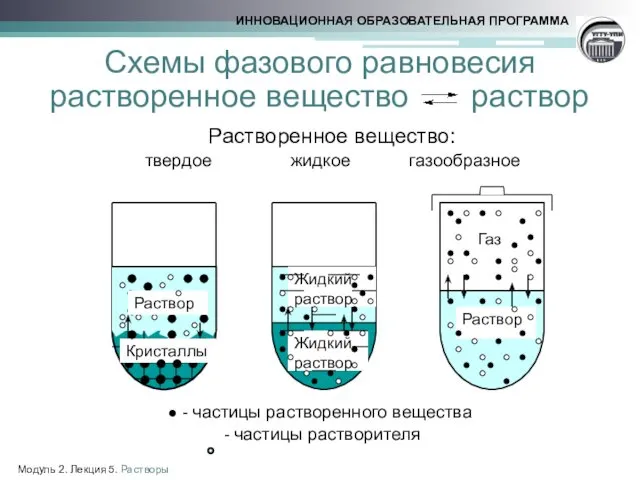
- 8. Схемы фазового равновесия растворенное вещество раствор Растворенное вещество: твердое жидкое газообразное ● - частицы растворенного вещества
- 9. Насыщенные растворы. Растворимость Насыщенный раствор – находящийся в фазовом равновесии с растворяемым веществом Растворимость вещества (моль/л)
- 10. Физико-химические процессы при растворении Растворение - совокупность физико-химических процессов, среди которых выделяют три основных, протекающих одновременно:
- 11. Энергетические эффекты при образовании растворов Значение энтальпии растворения (уравнение Фаянса): где ΔНK – энтальпия разрушения кристаллической
- 12. Влияние различных факторов на растворимость газов и жидкостей Растворимость газов в жидкостях С повышением температуры растворимость,
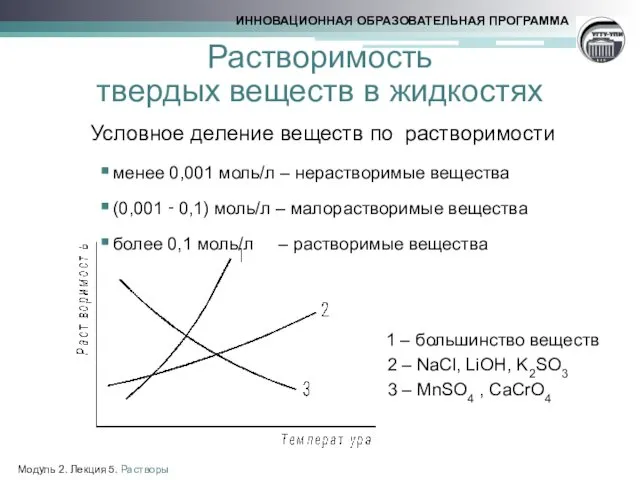
- 13. Растворимость твердых веществ в жидкостях Условное деление веществ по растворимости менее 0,001 моль/л – нерастворимые вещества
- 14. Закон распределения Распределение растворяющегося вещества между двумя несмешивающимися жидкостями происходит так, что отношение его равновесных концентраций
- 15. Экстракция Метод избирательного извлечения вещества из раствора (или твердой смеси) с помощью подходящего растворителя – экстрагента
- 16. Заключение Раствор представляет собой гомогенную систему переменного состава Количественная характеристика состава раствора - концентрация растворенного вещества:
- 18. Скачать презентацию











 Гражданско-правовая ответственность при перевозке
Гражданско-правовая ответственность при перевозке Автотрансформаторы
Автотрансформаторы Благоустройство общественной территории, строительство парковой зоны Лошадки
Благоустройство общественной территории, строительство парковой зоны Лошадки Город на Неве - Санкт-Петербург
Город на Неве - Санкт-Петербург Портфолио. Организация видов работ при эксплуатации и реконструкции строительных объектов
Портфолио. Организация видов работ при эксплуатации и реконструкции строительных объектов Брак и семья. Семья и здоровый образ жизни человека
Брак и семья. Семья и здоровый образ жизни человека Пушкин-лицеист
Пушкин-лицеист Гайд по девушке для задрота
Гайд по девушке для задрота Вредные привычки
Вредные привычки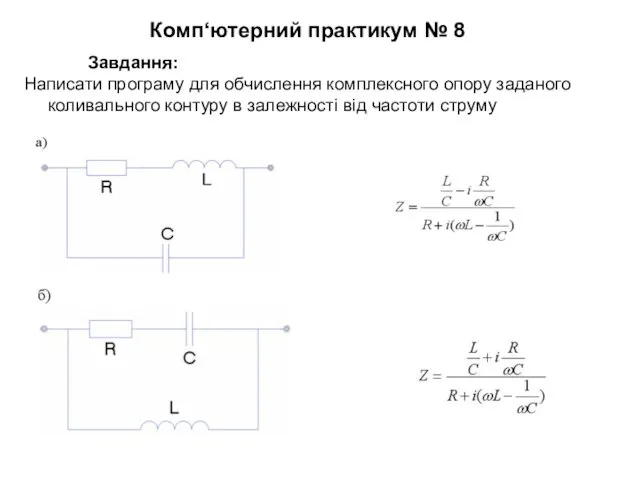 обчислення комплексного опору заданого коливального контуру в залежності від частоти струму
обчислення комплексного опору заданого коливального контуру в залежності від частоти струму Пресс-конференция Лесной комплекс России 9 класс
Пресс-конференция Лесной комплекс России 9 класс Java4 (Наследование и массивы)
Java4 (Наследование и массивы) Строительные материалы
Строительные материалы Медиалог. Комплексная информационная система для поликлиники, стационара, сети медицинских учреждений
Медиалог. Комплексная информационная система для поликлиники, стационара, сети медицинских учреждений Проект Мой родной город
Проект Мой родной город Урок-учет знаний по теме Решение систем уравнений.
Урок-учет знаний по теме Решение систем уравнений. Освещение вагона. Лампы накаливания
Освещение вагона. Лампы накаливания АРМ Подготовка расчетов Личные кабинеты
АРМ Подготовка расчетов Личные кабинеты Генотипическая (наследственная) изменчивость
Генотипическая (наследственная) изменчивость Бруцеллёз
Бруцеллёз Классный час, посвященный 70-летию Великой Победы
Классный час, посвященный 70-летию Великой Победы Учебные заведения в западной Европе в новое время
Учебные заведения в западной Европе в новое время Учение Рима-католической Церкви о таинствах
Учение Рима-католической Церкви о таинствах Болевой синдром после облучения
Болевой синдром после облучения Кейс-метод
Кейс-метод викторина Путешествие по сказкам
викторина Путешествие по сказкам презентация к открытому уроку Матрёшка на ладошке
презентация к открытому уроку Матрёшка на ладошке Процесс пищеварения в ротовой полости
Процесс пищеварения в ротовой полости