Слайд 2
«Надо учиться не для того, чтобы стать учёным, а только для того,
чтобы научиться жить лучше» Лев Толстой
«Три пути ведут к знанию: путь размышления - это самый благородный; путь подражания - это путь самый лёгкий и путь опыта - это путь самый горький» Конфуций

Слайд 3
Ионные реакции
В растворе электролиты распадаются на ионы и между ними могут протекать
химические реакции
Данные реакции называются ионными реакциями
Уравнения этих реакций называются ионными уравнениями

Слайд 4
Условия протекания реакций ионного обмена
Если образуется осадок (↓)
Если выделяется газ (↑)
Если образуется малодиссоциируемое
вещество (например, вода)

Слайд 5
Алгоритм составления реакций ионного обмена
Опыт 1
Написать молекулярное уравнение
2NaOH + H₂SO₄ = Na₂SO₄ +
2H₂O

Слайд 6
Правила составления уравнений
Вещества- электролиты записываем в виде ионов на которые они распадаются в
растворе, с учетом коэффициентов и индексов.
Формулы нерастворимых, газообразных и малодиссоциирующих веществ оставляем в молекулярном виде.

Слайд 7
Правила составления уравнений
коэффициент перед формулой вещества относится к обоим ионам ;
формулы многоатомных (сложных)
ионов не разрывают – ОН⁻, СО₃²⁻, NО₃⁻, SО₄²⁻, РО₄³⁻, НСО₃ˉ , НРО₄²⁻ и т.п.
индекс после иона переходит в ионном уравнении в коэффициент перед ним.

Слайд 8
Правила составления уравнений
2Na+ + 2OH- + 2H+ + SO4²- = 2Na+ + SO4²-
+ 2 H2O
Получаем полное ионное уравнение

Слайд 9
Правила составления уравнений
Определим одинаковые ионы, то есть ионы, не участвующие в реакции (они
находятся в правой и левой части уравнения в одинаковом количестве). Формулы этих ионов можно вычеркнуть (или подчеркнуть):
2Na ⁺ + 2OH⁻ +2H⁺ +SO₄²⁻ = 2Na⁺ +SO₄²⁻ + 2H2O

Слайд 10
Правила составления уравнений
Перепишем только те формулы, которые остались:
2OH ⁻ + 2H ⁺ =2H₂O
OH
⁻ + H⁺ = H₂O
Получаем сокращённое ионное уравнение

Слайд 11
Вывод
Сокращённое ионное уравнение выражает сущность реакции ионного обмена

Слайд 12
Опыт 2 Образование осадка
FeCI₃ + 3NaOH = Fe(OH)₃↓+ 3NaCI
Fe³⁺ +3CI⁻ +3Na⁺ +3OH⁻ =
Fe(OH)₃↓ + 3Na⁺+ 3CI⁻
Fe³⁺ + 3OH⁻ = Fe(OH)₃↓

Слайд 13
Опыт 3 Растворение осадка
2Fe(OH)₃↓+3H₂SO₄ = Fe₂(SO₄)₃+ 6H₂O
2Fe(OH)₃↓+6H⁺+3SO₄²⁻=2Fe³⁺+3SO₄²⁻ +6H₂O
2Fe(OH)₃↓+6H⁺= 2Fe³⁺+ 6H₂O

Слайд 14
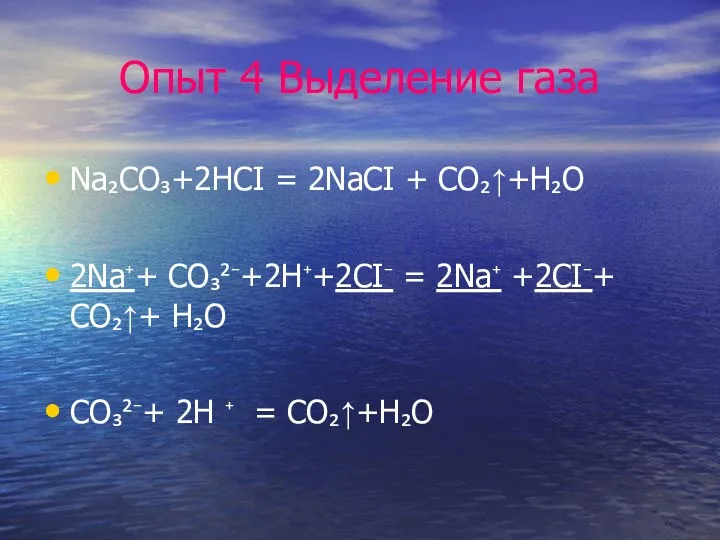
Опыт 4 Выделение газа
Na₂CO₃+2HCI = 2NaCI + CO₂↑+H₂O
2Na⁺+ CO₃²⁻+2H⁺+2CI⁻ = 2Na⁺ +2CI⁻+ CO₂↑+
H₂O
CO₃²⁻+ 2H ⁺ = CO₂↑+H₂O













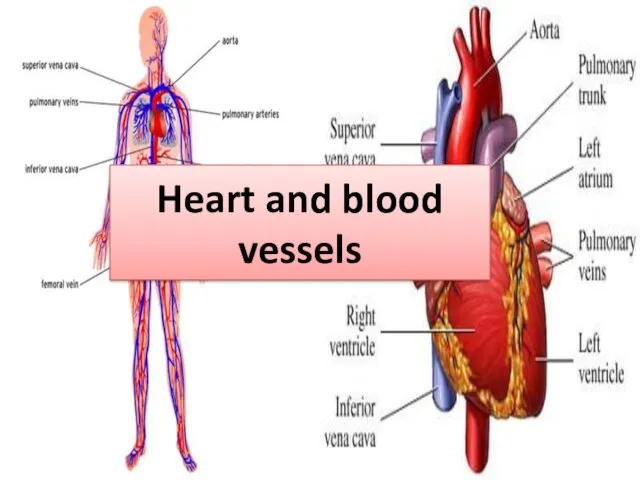 Heart and blood vessels
Heart and blood vessels Вопросы употребления никотинсодержащих смесей несовершеннолетними
Вопросы употребления никотинсодержащих смесей несовершеннолетними Чтоб весною птичек слушать, дай зимою им покушать. Презентация
Чтоб весною птичек слушать, дай зимою им покушать. Презентация Швартовка и совместная стоянка судов в открытом море
Швартовка и совместная стоянка судов в открытом море Презентация Их именами названы улицы Ульяновска
Презентация Их именами названы улицы Ульяновска Художественная культура Китая
Художественная культура Китая Даниель Дефо (1660-1731). Роман Робинзон Крузо
Даниель Дефо (1660-1731). Роман Робинзон Крузо Школа дошколят Звонкие ладошки занятие 1
Школа дошколят Звонкие ладошки занятие 1 Шаблон 8 марта (тюльпаны)
Шаблон 8 марта (тюльпаны) Технология возведения кирпичных зданий
Технология возведения кирпичных зданий Christmas
Christmas Антикризисное управление персоналом организации. (Лекция 11)
Антикризисное управление персоналом организации. (Лекция 11) От Средневековья к Новому времени
От Средневековья к Новому времени Проблемы проявления интернет-зависимости среди подростков
Проблемы проявления интернет-зависимости среди подростков Внутренняя структура
Внутренняя структура Презентация Агротехника возделывания томатов
Презентация Агротехника возделывания томатов Молодежный форум Северо-Западного федерального округа Ладога
Молодежный форум Северо-Западного федерального округа Ладога Сказки про усатых-полосатых
Сказки про усатых-полосатых ван
ван ДМ Режимы работы СПиР
ДМ Режимы работы СПиР Benim ailem
Benim ailem Учет основных средств
Учет основных средств МАОУ СОШ №21
МАОУ СОШ №21 Контроль и оценка результатов обучения. Принципы формирующего оценивания. Лекция 11
Контроль и оценка результатов обучения. Принципы формирующего оценивания. Лекция 11 Умножение десятичной дроби на обыкновенную
Умножение десятичной дроби на обыкновенную Сердечно-сосудистая система
Сердечно-сосудистая система Тюменский индустриальный университет. ВУЗ, устремленный в будущее
Тюменский индустриальный университет. ВУЗ, устремленный в будущее Жұмысшы уақытының және жабдықты пайдалану уақытының шығындарын сыныптау
Жұмысшы уақытының және жабдықты пайдалану уақытының шығындарын сыныптау