Содержание
- 2. Массовая доля выхода продукта реакции (η - «этта») - это отношение массы полученного вещества к массе,
- 3. Объемная доля выхода продукта реакции (φ - «фи») - это отношение массы полученного вещества к массе,
- 4. Многие химические реакции не доходят до конца. При взаимодействии органических веществ часто образуются побочные продукты. При
- 5. Три типа задач с понятием «Выход продукта» 1. Даны массы(объемы) исходного вещества и продукта реакции. Определить
- 6. 1) Прочитай внимательно условие задачи 2) Запиши: «Дано» и «Найти». 3) Составь уравнение реакции (не забудь
- 7. При действии алюминия на оксид цинка массой 32,4г получили 24 г цинка. Найдите массовую долю выхода
- 8. Дано: m(ZnO) = 32,4 г mпр(Zn) = 24 г Найти: ηвых(Zn) - ? Решение: 3. Составьте
- 9. Дано: Решение: m (ZnO) = 32,4 г 32,4 г ? m пр (Zn) = 24 г
- 10. Дано: Решение: m (ZnO) = 32,4 г 32,4 г ? m пр (Zn) = 24 г
- 11. 1) Прочитай внимательно условие задачи 2) Запиши: «Дано» и «Найти». 3) Составь уравнение реакции (не забудь
- 12. Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции
- 13. 3) Составь уравнение реакции (не забудь расставить коэффициенты). Дано: Решение: m (Al(OH)3)= 23,4 г η вых
- 14. 4. Вычисли массу теоретическую продукта реакции Дано: m (Al(OH)3)= 23,4 г η вых (Al2O3) = 92%
- 15. 5) Вычисли массу практическую продукта реакции, воспользовавшись обратной формулой (умножь массу теоретическую на долю выхода) Дано:
- 16. Алгоритм решения задач третьего типа (Определить массу исходного вещества) Прочитай внимательно условие задачи. 2) Запиши: «Дано»
- 17. 1. Внимательно прочитай условие задачи При действии оксида углерода (II) на оксид железа (III) получено железо
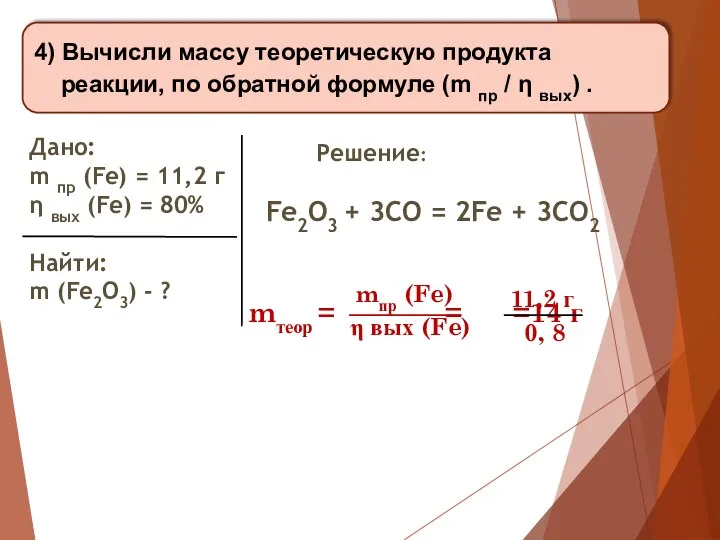
- 18. 3) Составь уравнение реакции (не забудь расставить коэффициенты). Дано: m пр (Fe) = 11,2 г η
- 19. 4) Вычисли массу теоретическую продукта реакции, по обратной формуле (m пр / η вых) . Дано:
- 20. 5) Вычисли массу исходного вещества по уравнению реакции. Дано: m пр (Fe) = 11,2 г η
- 22. Скачать презентацию


















 Қытай мен Қазақстанның байланысы
Қытай мен Қазақстанның байланысы Рисуем цветы
Рисуем цветы Презентация по ознакомлению и профилактике детей с правилами дорожного движения.
Презентация по ознакомлению и профилактике детей с правилами дорожного движения. Система тематических дней
Система тематических дней Решение развивающих практико-ориентированных задач
Решение развивающих практико-ориентированных задач Гипотеза панспермии
Гипотеза панспермии Islam. Przewodnik po religii
Islam. Przewodnik po religii Новые проекты Санкт-Петербурга
Новые проекты Санкт-Петербурга Лабораторные методы исследования
Лабораторные методы исследования Внутренняя политика Александра III
Внутренняя политика Александра III Способы разделения смесей
Способы разделения смесей Команда 26 ВятГу-челленджа. Киров глазами первокурсников
Команда 26 ВятГу-челленджа. Киров глазами первокурсников О благодарных и неблагодарных (исцеление десяти прокажённых) (Св. Евангелие от Луки 17:11-19)
О благодарных и неблагодарных (исцеление десяти прокажённых) (Св. Евангелие от Луки 17:11-19) Прощеное воскресенье
Прощеное воскресенье Стандарттау әдістері
Стандарттау әдістері Современные способы стыковки арматуры
Современные способы стыковки арматуры Федеральное агентство воздушного транспорта (Росавиация)
Федеральное агентство воздушного транспорта (Росавиация) Церковь Покрова на Нерли
Церковь Покрова на Нерли презентация Журналист-школьник. Миф или реальность
презентация Журналист-школьник. Миф или реальность Исследовательский проект Мой прадедушка – участник Великой Отечественной войны
Исследовательский проект Мой прадедушка – участник Великой Отечественной войны Семейные праздники
Семейные праздники Строительная компания Риэлт Строй 36-86-00 rsdoma.ru
Строительная компания Риэлт Строй 36-86-00 rsdoma.ru Территориальный маркетинг в системе регионального управления
Территориальный маркетинг в системе регионального управления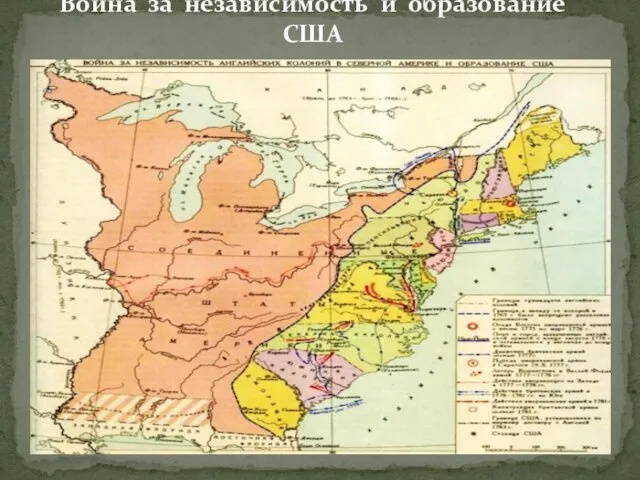 Война за независимость и образование США
Война за независимость и образование США Умники и умницы. Интеллектуальная игра
Умники и умницы. Интеллектуальная игра Конструирование из мозаики
Конструирование из мозаики Достопримечательности Нового Уренгоя
Достопримечательности Нового Уренгоя Стрілові самохідні крани. (Лекція 7)
Стрілові самохідні крани. (Лекція 7)