Содержание
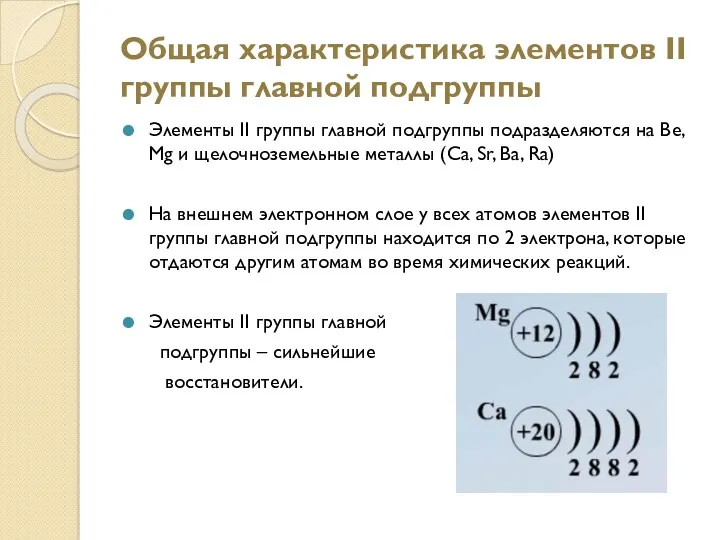
- 2. Общая характеристика элементов II группы главной подгруппы Элементы II группы главной подгруппы подразделяются на Ве, Mg
- 3. Нахождение в природе. Физические свойства. Be Открыт в 1798 году (Воклен, Франция), получен в виде металла
- 4. Mg впервые получен в 1808 году (Дэви, Англия). Mg – восьмой по распространенности элемент в литосфере
- 5. Са Получен в виде металла впервые в 1808 году (Дэви, Англия). Кальций – пятый по распространенности
- 6. Sr, Ba в виде металлов впервые получены в 1808 г )Дэви, Англия) Карбонаты и сульфаты обоих
- 7. Ra обнаружен в 1989 г (Мария и Пьер Кюри, Франция) в урановой смоляной руде. Радий относится
- 8. ХИМИЧЕСКИЕ СВОЙСТВА Элементы II группы главной подгруппы при нагревании на воздухе сгорают с образованием оксидов:
- 9. При нагревании взаимодействуют с неметаллами: хлором, серой, азотом и пр. Образуя, при этом, хлориды, сульфиды, нитриды.
- 10. При высоких температурах окисляются водородом до гидридов Гидриды – твердые солеподобные соединения, напоминающие галогениды. Именно поэтому
- 11. Все металлы II группы главной подгруппы, кроме Be, взаимодействуют с водой при обычных условиях. Активность взаимодействия
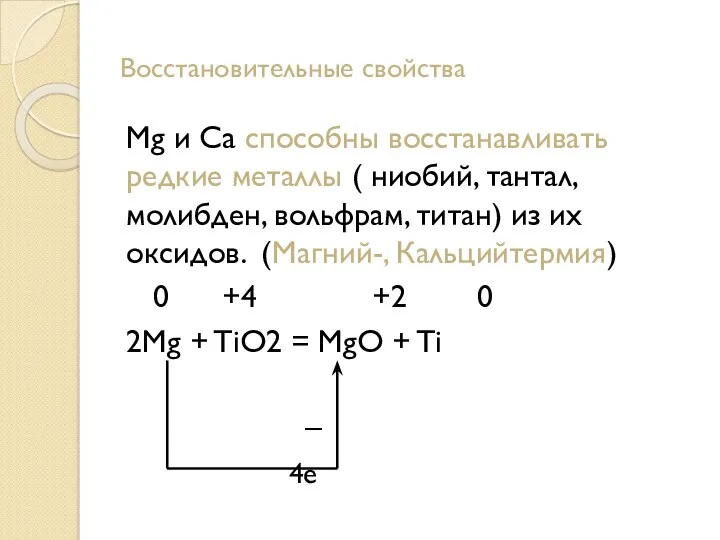
- 12. Восстановительные свойства Mg и Ca способны восстанавливать редкие металлы ( ниобий, тантал, молибден, вольфрам, титан) из
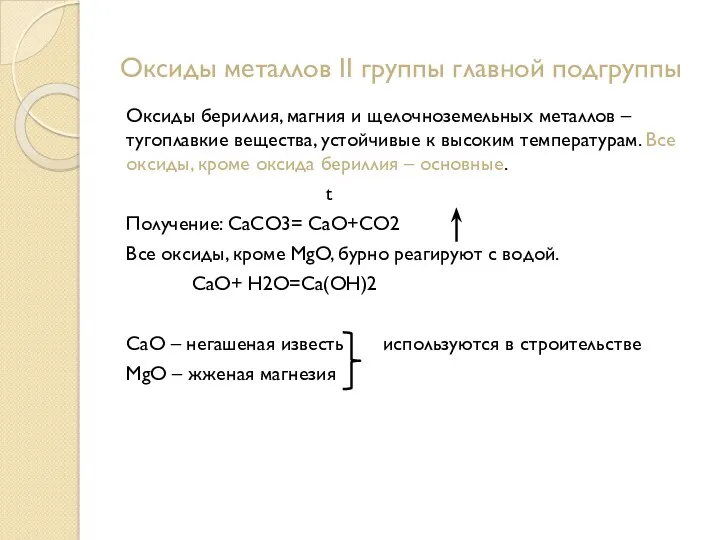
- 13. Оксиды металлов II группы главной подгруппы Оксиды бериллия, магния и щелочноземельных металлов – тугоплавкие вещества, устойчивые
- 14. Гидроксиды металлов II группы главной подгруппы Гидроксиды – являются щелочами. Растворимость гидроксидов усиливается в ряду: Ca(OH)2
- 15. Соли Получение: взаимодействием металлов с кислотами Be + H2SO4 = BeSO4 + H2 Сульфаты – растворимы
- 16. Важнейшие соединения элементов II группы главной подгруппы CaCO3 Карбонат кальция Наиболее распространенное на Земле соединение. Встречается
- 17. MgCO3 карбонат магния Используют при производстве кирпича, стекла, цемента, в металлургии для перевода пустой породы в
- 18. «Восточный» алебастр высоко ценился, из него делалась маленькие сосуды для парфюмерных изделий и вазы для мазей,
- 19. MgSO4 сульфат магния Английская или «горькая соль». Используется в медицине в качестве слабительного средства. Придает соленый
- 20. Ca3(PO4)2 фосфат кальция Входит в состав фосфоритов и апатитов Входит в состав костей и зубов человека
- 21. Человек должен получать в день 1.5 г Ca
- 22. В организме человека содержится около 40 г Mg
- 24. Скачать презентацию


















 Як святкують новий рік у різних країнах світу
Як святкують новий рік у різних країнах світу Общие черты и особенности экономического развития Германии и США в конце 19-ого-начале 20-ого века
Общие черты и особенности экономического развития Германии и США в конце 19-ого-начале 20-ого века интеллектуальный марафон
интеллектуальный марафон Организация практики
Организация практики Осциллографы
Осциллографы Материк Евразия. Обобщение. 7 класс
Материк Евразия. Обобщение. 7 класс Древний Египет
Древний Египет Методы защиты от коррозии
Методы защиты от коррозии Вазоконстрикторы и антигипотензивные средства
Вазоконстрикторы и антигипотензивные средства Химико-технологическая система, ее состав и структура
Химико-технологическая система, ее состав и структура Экология. Общая экология. Экологическое право. Экология популяций и экосистем
Экология. Общая экология. Экологическое право. Экология популяций и экосистем Хочу всё знать. Интеллектуальная игра для дошкольников
Хочу всё знать. Интеллектуальная игра для дошкольников Презентация к методическому семинару
Презентация к методическому семинару Правонарушение. Юридическая ответственность и её виды
Правонарушение. Юридическая ответственность и её виды Сучасні програмні продукти моделювання та симуляції електронних схем
Сучасні програмні продукти моделювання та симуляції електронних схем Базовые конкурентные стратегии по Майклу Портеру
Базовые конкурентные стратегии по Майклу Портеру Разработка открытого урока, данный в ходе всероссийского конкурса- Учитель года-2014 по теме Реки.
Разработка открытого урока, данный в ходе всероссийского конкурса- Учитель года-2014 по теме Реки. Как не стать жертвой наркомании
Как не стать жертвой наркомании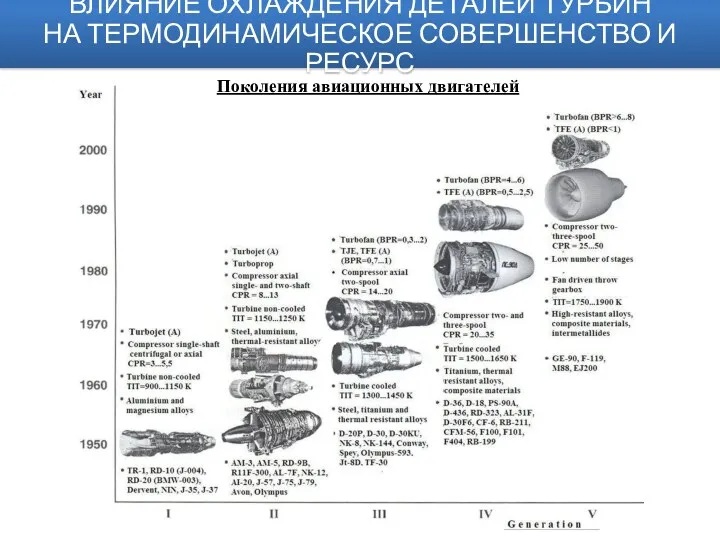 Авиационные двигатели. Влияние охлаждения деталей турбин на термодинамическое совершенство и ресурс прочности лопаток
Авиационные двигатели. Влияние охлаждения деталей турбин на термодинамическое совершенство и ресурс прочности лопаток Мембранные покрытия
Мембранные покрытия Коррекция речевых нарушений у старших дошкольников в условиях логопедического пункта в ДОУ
Коррекция речевых нарушений у старших дошкольников в условиях логопедического пункта в ДОУ Аппаратная часть компьютерной системы
Аппаратная часть компьютерной системы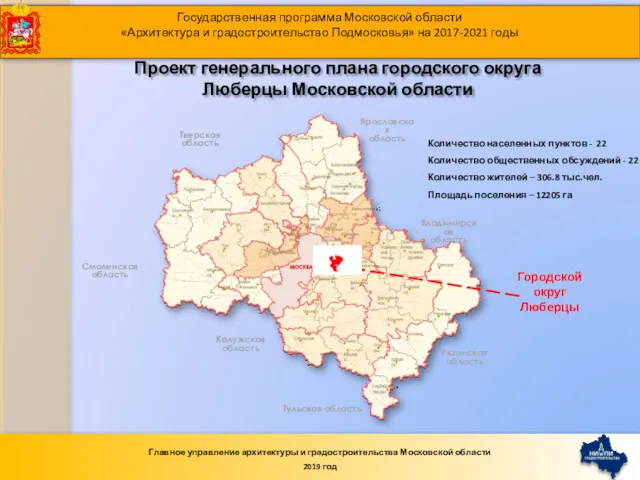 Проект генерального плана городского округа Люберцы Московской области
Проект генерального плана городского округа Люберцы Московской области Классный час Откуда берутся грязнули
Классный час Откуда берутся грязнули Винсент Ван Гог 1853-1890 (37 лет)
Винсент Ван Гог 1853-1890 (37 лет) Зимний подарок Презентация
Зимний подарок Презентация Презентация Живи, память, живи!
Презентация Живи, память, живи! Презентация Курить - здоровью вредить.
Презентация Курить - здоровью вредить.