- Главная
- Без категории
- Щелочные металлы

Содержание
- 2. Щелочные металлы
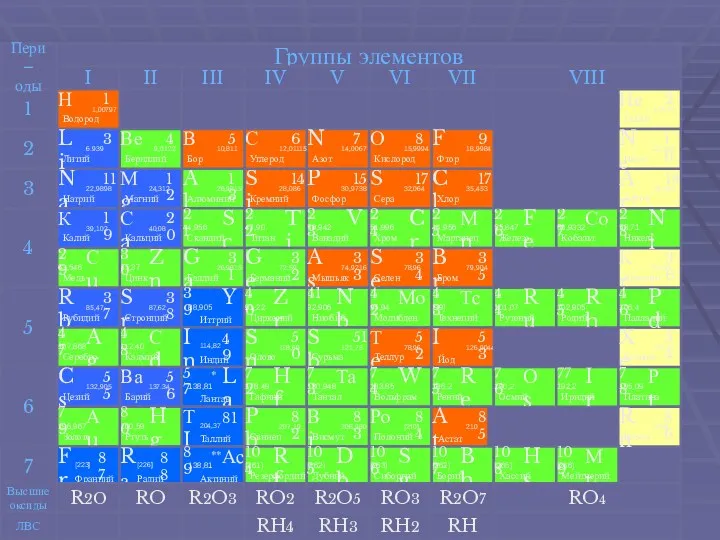
- 3. Щелочные металлы Щелочные металлы -это элементы 1-й группы периодической таблицы химических элементов. При растворении щелочных металлов,
- 4. Общая характеристика щелочных металлов В Периодической системеВ Периодической системе они следуют сразу за инертными газамиВ Периодической
- 5. Химические свойства а)с простыми веществами: 2Li + Н2 = 2LiН – гидрид лития; 2К + Сl2
- 6. Физические свойства Серебристо – белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности. Все
- 7. Получение щелочных металлов 1. Для получения щелочных металлов используют в основном электролизэлектролизрасплавовэлектролизрасплавов их галогенидов, чаще всего
- 8. Соединения щелочных металлов Для получения гидроксидовДля получения гидроксидов щелочных металловДля получения гидроксидов щелочных металлов в основном
- 9. Щелочные металлы- простые вещества Литий Натрий
- 10. Получение лития Литий был открыт в 1817 годуЛитий был открыт в 1817 году шведским химиком и
- 11. Получение натрия В1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил свободные металлы - калий,
- 12. Щелочные металлы Калий Рубидий
- 13. Получение рубидия В 1861 году немецкие учёные Роберт Вильгельм Бунзен и Густав Роберт КирхгофВ 1861 году
- 14. Получение калия В 1807 годуВ 1807 году английский химик ДэвиВ 1807 году английский химик Дэви электролизом
- 15. Цезий Цезий
- 16. Получение цезия Цезий был открыт в 1860 годуЦезий был открыт в 1860 году немецкими учёными Р.
- 18. Скачать презентацию
Щелочные металлы
Щелочные металлы
Щелочные металлы
Щелочные металлы -это элементы 1-й группы периодической таблицы химических элементов.
При
Щелочные металлы
Щелочные металлы -это элементы 1-й группы периодической таблицы химических элементов.
При
Общая характеристика щелочных металлов
В Периодической системеВ Периодической системе они следуют сразу за инертными
Общая характеристика щелочных металлов
В Периодической системеВ Периодической системе они следуют сразу за инертными
Химические свойства
а)с простыми веществами:
2Li + Н2 = 2LiН – гидрид
Химические свойства
а)с простыми веществами:
2Li + Н2 = 2LiН – гидрид
2К + Сl2 = 2КСl – хлорид калия;
2Nа + S = Nа2S – сульфид натрия;
4 Li + О2 = 2Li2О – оксид лития.
б) со сложными веществами
2Nа + 2НОН = 2NаОН + Н2
Физические свойства
Серебристо – белые мягкие вещества (режутся ножом), с характерным блеском
Физические свойства
Серебристо – белые мягкие вещества (режутся ножом), с характерным блеском
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролизэлектролизрасплавовэлектролизрасплавов их галогенидов, чаще всего — хлоридов, чаще всего — хлоридов,
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролизэлектролизрасплавовэлектролизрасплавов их галогенидов, чаще всего — хлоридов, чаще всего — хлоридов,
катод: Li+ + e → Li
анод: 2Cl− — 2e → Cl2
2. Иногда для получения щелочных металлов Иногда для получения щелочных металлов проводят электролиз Иногда для получения щелочных металлов проводят электролиз расплавов Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
катод: Na+ + e → Na
анод: 4OH− — 4e → 2H2O + O2
Соединения щелочных металлов
Для получения гидроксидовДля получения гидроксидов щелочных металловДля получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее
Соединения щелочных металлов
Для получения гидроксидовДля получения гидроксидов щелочных металловДля получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее
Получаемая таким способом щёлочьПолучаемая таким способом щёлочь была сильно загрязнена содой Na2CO3
Щелочные металлы-
простые вещества
Литий Натрий
Щелочные металлы-
простые вещества
Литий Натрий
Получение лития
Литий был открыт в 1817 годуЛитий был открыт в 1817 году шведским химиком и
Получение лития
Литий был открыт в 1817 годуЛитий был открыт в 1817 году шведским химиком и
Получение натрия
В1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил
Получение натрия
В1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил
Щелочные металлы
Калий Рубидий
Щелочные металлы
Калий Рубидий
Получение рубидия
В 1861 году немецкие учёные Роберт Вильгельм Бунзен и Густав Роберт КирхгофВ
Получение рубидия
В 1861 году немецкие учёные Роберт Вильгельм Бунзен и Густав Роберт КирхгофВ
Получение калия
В 1807 годуВ 1807 году английский химик ДэвиВ 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил
Получение калия
В 1807 годуВ 1807 году английский химик ДэвиВ 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил
Цезий
Цезий
Цезий
Цезий
Получение цезия
Цезий был открыт в 1860 годуЦезий был открыт в 1860 году немецкими учёными Р. В. БунзеномЦезий
Получение цезия
Цезий был открыт в 1860 годуЦезий был открыт в 1860 году немецкими учёными Р. В. БунзеномЦезий














 Школа светофорных наук
Школа светофорных наук Мифологические сюжеты в искусстве
Мифологические сюжеты в искусстве к лекции по ЖД
к лекции по ЖД Ассортимент и особенности приготовления блюд белорусской кухни
Ассортимент и особенности приготовления блюд белорусской кухни Порядок организации и осуществления подготовки различных групп населения в области гражданской обороны и защиты от ЧС
Порядок организации и осуществления подготовки различных групп населения в области гражданской обороны и защиты от ЧС Презентация Роль дидактической игры в коррекционно-воспитательном процессе
Презентация Роль дидактической игры в коррекционно-воспитательном процессе Общие сведения о горных работах. Вентиляция, водоотлив, освещение, подземные пожары и горноспасательное дело
Общие сведения о горных работах. Вентиляция, водоотлив, освещение, подземные пожары и горноспасательное дело Металлические контейнеры Гудпак MB5 для синтетического каучука
Металлические контейнеры Гудпак MB5 для синтетического каучука Третья республика во Франции в период между двумя войнами. Конституционное развитие Франции после Второй мировой войны
Третья республика во Франции в период между двумя войнами. Конституционное развитие Франции после Второй мировой войны Eвропейский стандарт цифрового эфирного телевидения DVB-T2
Eвропейский стандарт цифрового эфирного телевидения DVB-T2 Архитектурные памятники Санкт-Петербурга
Архитектурные памятники Санкт-Петербурга Основы математической логики
Основы математической логики Е. Благинина Кукушка и Котёнок
Е. Благинина Кукушка и Котёнок Подписано кровью: послания св. Игнатия Антиохийского
Подписано кровью: послания св. Игнатия Антиохийского Художественная культура средневекового Востока
Художественная культура средневекового Востока Международные правила полетов. Радиообеспечение
Международные правила полетов. Радиообеспечение Медицинское страхование. Медицинское страхование в системе социального страхования
Медицинское страхование. Медицинское страхование в системе социального страхования The Izmailovsky Cathedral of the Holy Trinity
The Izmailovsky Cathedral of the Holy Trinity Волонтёр. Волонтёрская деятельность
Волонтёр. Волонтёрская деятельность Питание и здоровье
Питание и здоровье классный час по теме умеем ли мы прощать
классный час по теме умеем ли мы прощать Мировой рынок функциональных продуктов и бад
Мировой рынок функциональных продуктов и бад Физминутка для глаз.
Физминутка для глаз. 2_5370562634611430795 (1) (1)
2_5370562634611430795 (1) (1) 5 героев Сталинградской битвы
5 героев Сталинградской битвы Определение географических координат на глобусе и карте
Определение географических координат на глобусе и карте Семиотика, синдромология и лабораторно-инструментальная диагностика различных форм поражения плевры
Семиотика, синдромология и лабораторно-инструментальная диагностика различных форм поражения плевры Таблетка алудың негізгі әдістері
Таблетка алудың негізгі әдістері