Содержание
- 2. «Алхимию постигнуть каждый рад: Безумный идиот, старик и юный фат, Портной, старуха, юркий адвокат, Монах плешивый,
- 3. План урока 1. Записать химические символы щелочных металлов. 2. Изменение свойств в группе. 3. Физические свойства
- 4. Строение атомов I группы главной подгруппы II Li +3 ) ) порядковый номер 2 1 заряд
- 5. Физические свойства: «Первой группы элементы одинаково валентны, Легкоплавки и мягки, серебристы, как снежки, Только с ними
- 6. Живет обычно в керосине И бегает он по воде, В природе, в комнате – отныне Свободным
- 7. Опять в таблицу посмотрите: На третьем месте литий встал. Второй период начал литий, Ведь это щелочной
- 8. 4. Химические свойства: а. с водородом б. с галогенами в. с серой г. с кислородом д.
- 9. Щелочные металлы и их соединения 1. Выберите щелочные металлы и запишите их в порядке увеличения восстановительных
- 10. Соединения щелочных металлов Задания по теме «Щелочные металлы» Закончить уравнения возможных реакции А) K2O + H2O=
- 11. А) Глауберова соль 1) K2SO4 7) Na2CO3 Б) Карбонат натрия 2) Na2CO3*10H2O 8) NaHCO3 В) Пищевая
- 13. Скачать презентацию










 Перпендикулярность прямых и плоскостей
Перпендикулярность прямых и плоскостей Методы формирования и обработки аналоговых радиосигналов в аппаратуре радиосвязи. К лекции 3
Методы формирования и обработки аналоговых радиосигналов в аппаратуре радиосвязи. К лекции 3 Территория Калмыкии в древности
Территория Калмыкии в древности Архитектурные памятники Липецкой области
Архитектурные памятники Липецкой области Трудности адаптационного периода в 5 классе и пути его преодоления.
Трудности адаптационного периода в 5 классе и пути его преодоления. Землеройно-транспортные машины
Землеройно-транспортные машины Порядок предоставления субсидий из бюджета Пермского края бюджетам муниципальных образований Пермского края
Порядок предоставления субсидий из бюджета Пермского края бюджетам муниципальных образований Пермского края ТОО Spa-sky production
ТОО Spa-sky production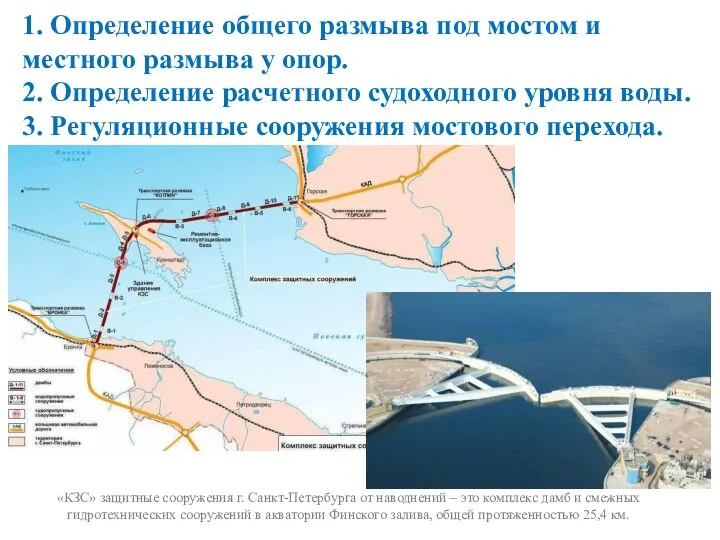 Определение общего размыва под мостом и местного размыва у опор
Определение общего размыва под мостом и местного размыва у опор Westfälische Wilhelms-Universität Münster
Westfälische Wilhelms-Universität Münster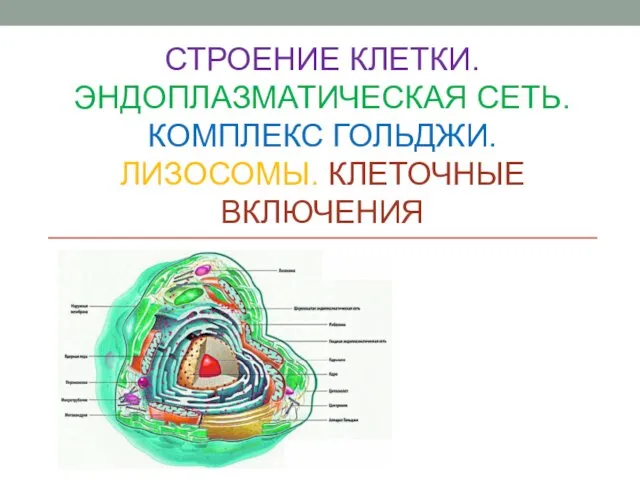 Строение клетки. Эндоплазматическая сеть. Комплекс гольджи. Лизосомы. Клеточные включения
Строение клетки. Эндоплазматическая сеть. Комплекс гольджи. Лизосомы. Клеточные включения Лихорадка неясного генеза
Лихорадка неясного генеза Воронежская область
Воронежская область Проблема патриотизма в молодежной среде (исследовательская работа)
Проблема патриотизма в молодежной среде (исследовательская работа) Визволення України від нацистських загарбників
Визволення України від нацистських загарбників Презентация гимнастики пробуждения по Ефименко Н.Н в средней группе
Презентация гимнастики пробуждения по Ефименко Н.Н в средней группе Презентации для 10 класса по химии
Презентации для 10 класса по химии С 75-летием Великой победы!
С 75-летием Великой победы! Ювелирное ремесло. Изготовление филигранного браслета в ручную
Ювелирное ремесло. Изготовление филигранного браслета в ручную День матери
День матери Митоз, мейоз, размножение, оплодотворение
Митоз, мейоз, размножение, оплодотворение Формирование читательской грамотности у учащихся на уроках обществознания и истории: смысловое чтение
Формирование читательской грамотности у учащихся на уроках обществознания и истории: смысловое чтение Презентация ко Дню Героев России
Презентация ко Дню Героев России Отчет о работе Владимирского обкома профсоюза работников культуры за период 2020 г
Отчет о работе Владимирского обкома профсоюза работников культуры за период 2020 г Презентация по теме:Проектная деятельность учащихся на уроке и во внеклассной работе
Презентация по теме:Проектная деятельность учащихся на уроке и во внеклассной работе Разработка урока по тема: Атмосфера Земли
Разработка урока по тема: Атмосфера Земли Повышение качества образования в дошкольном учреждении через художественно-эстетическое воспитание детей.
Повышение качества образования в дошкольном учреждении через художественно-эстетическое воспитание детей. Киберспорт. Соревнования по киберспорту
Киберспорт. Соревнования по киберспорту