Содержание
- 2. Основные функции воды в организме Обеспечение процессов всасывания и механического передвижения питательных веществ Поддержание оптимального осмотического
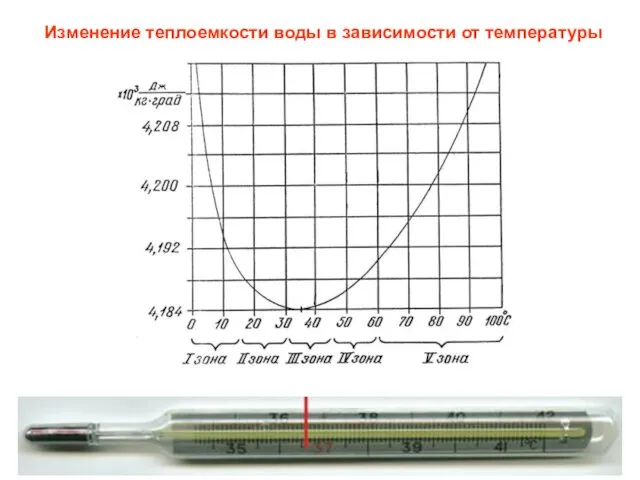
- 3. Изменение теплоемкости воды в зависимости от температуры
- 4. Значение растворов в жизнедеятельности организмов. Важнейшие биологические жидкости - кровь, лимфа моча, слюна, пот являются растворами
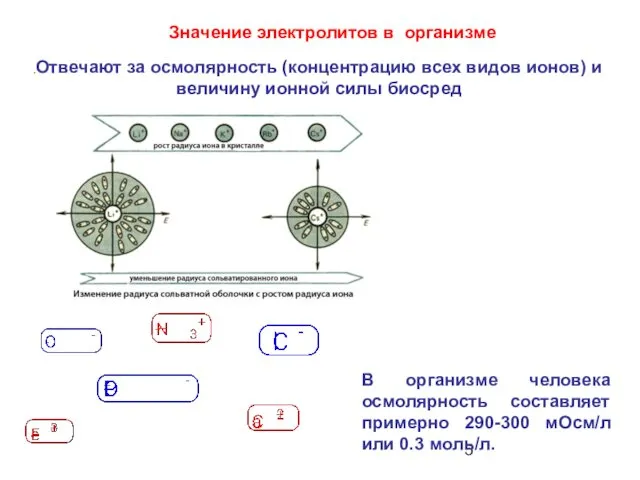
- 5. Отвечают за осмолярность (концентрацию всех видов ионов) и величину ионной силы биосред Значение электролитов в организме
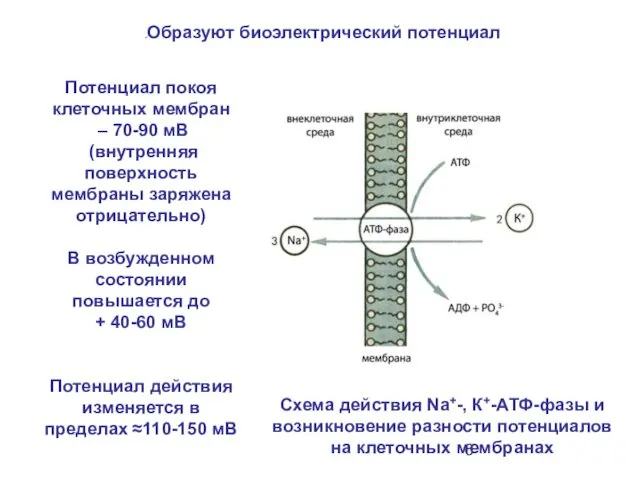
- 6. Схема действия Na+-, К+-АТФ-фазы и возникновение разности потенциалов на клеточных мембранах Потенциал покоя клеточных мембран –
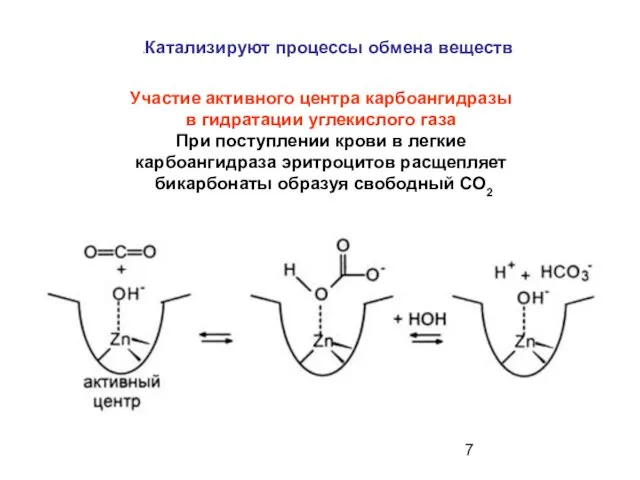
- 7. Участие активного центра карбоангидразы в гидратации углекислого газа При поступлении крови в легкие карбоангидраза эритроцитов расщепляет
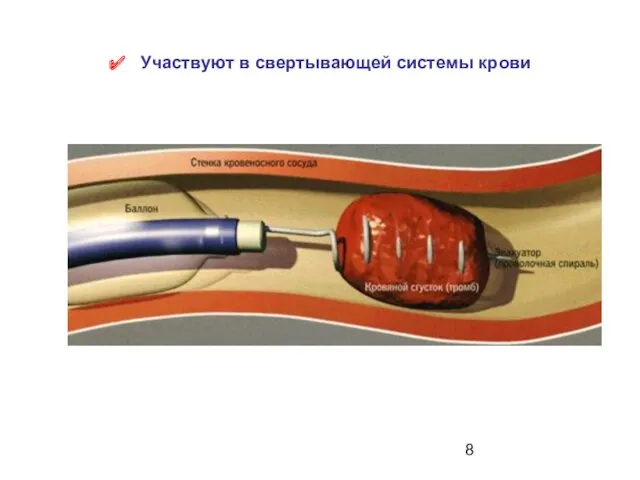
- 8. Участвуют в свертывающей системы крови
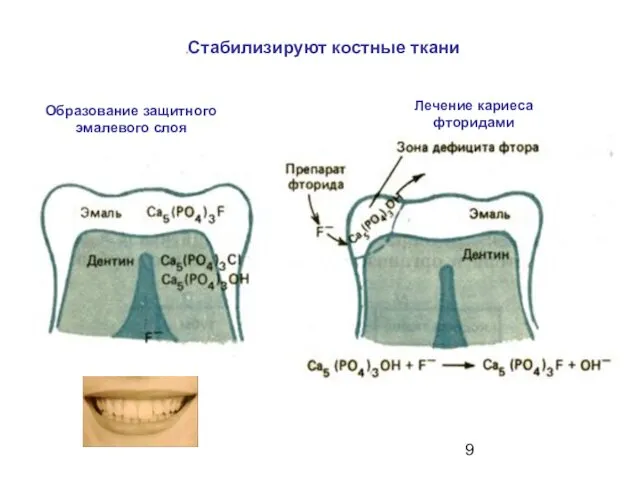
- 9. Образование защитного эмалевого слоя Лечение кариеса фторидами Стабилизируют костные ткани
- 10. Какие б чувства не таились Тогда во мне - теперь их нет: Они прошли иль изменились...
- 11. КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ Имеющую огромное значение для химии чистую воду... можно рассматривать как слабую кислоту или слабое
- 12. При 25 °С Кд =1.8·10 -16 Концентрацию молекул воды как в чистой воде, так и в
- 13. В соответствии с принципом Ле Шателье при добавлении кислот или оснований равновесие H2O ↔ H+ +
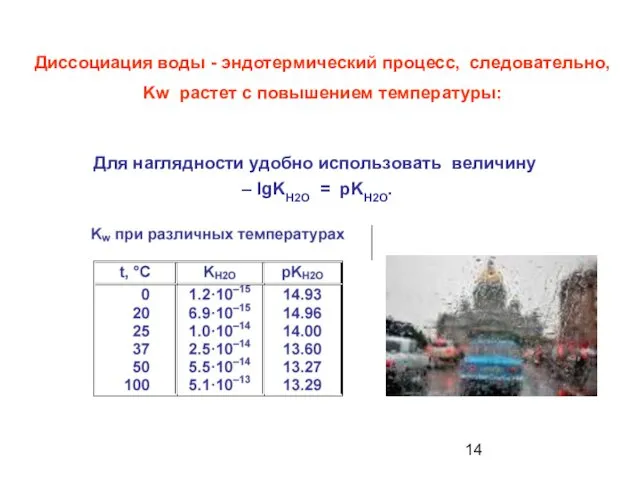
- 14. Диссоциация воды - эндотермический процесс, следовательно, Kw растет с повышением температуры: Для наглядности удобно использовать величину
- 15. Для удобства в расчетах пользуются величинами водородного и гидроксильного показателей - рH и рОН, pH -
- 17. Для чистой воды рН=7 Дождевая вода за счет растворенного СО2 имеет рН ~ 5.5 – 6.0
- 18. Памятник Джорджу Вашингтону в Нью-Йорке в момент открытия и через 60 лет Мрамор СаСО3 под действием
- 19. Бронзовый памятник во влажном воздухе медленно покрывается налетом основного карбоната меди (СuOH)2CO3
- 20. Александр Федорович Тур (1894–1974) 1930-1934 -заведующий кафедрой физиологии, гигиены и диететики ребенка 1934-1939 - заведующий кафедрой
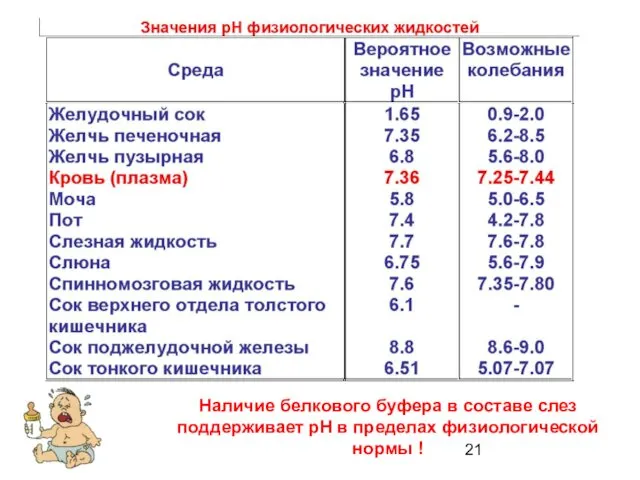
- 21. Наличие белкового буфера в составе слез поддерживает рН в пределах физиологической нормы !
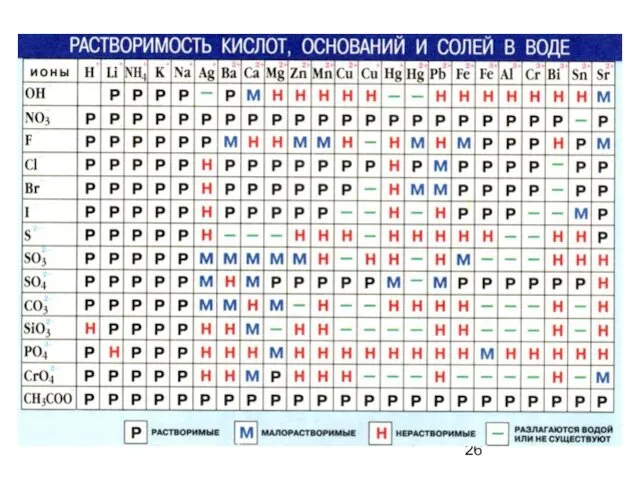
- 22. Электролиты – вещества, растворы и расплавы которых проводят электрический ток вследствие диссоциации на ионы. Расчет рН
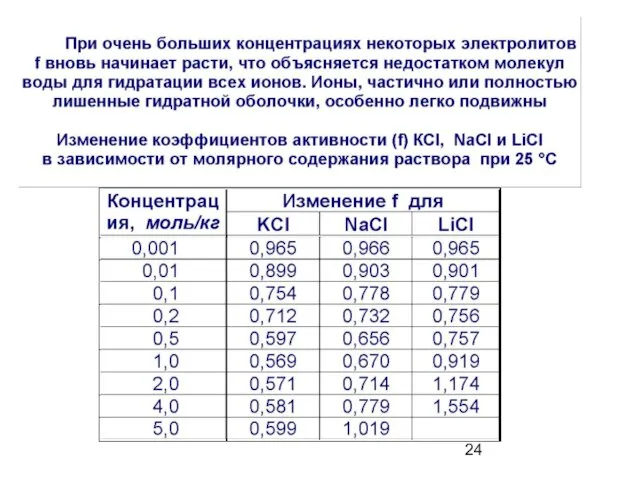
- 23. Сильные электролиты диссоциируют полностью, необратимо, в одну ступень. a – активность иона f – коэффициент активности,
- 25. К сильным электролитам относятся: 1. Кислоты - НСI , НВг , HI , H2SО4 , H2S2O7
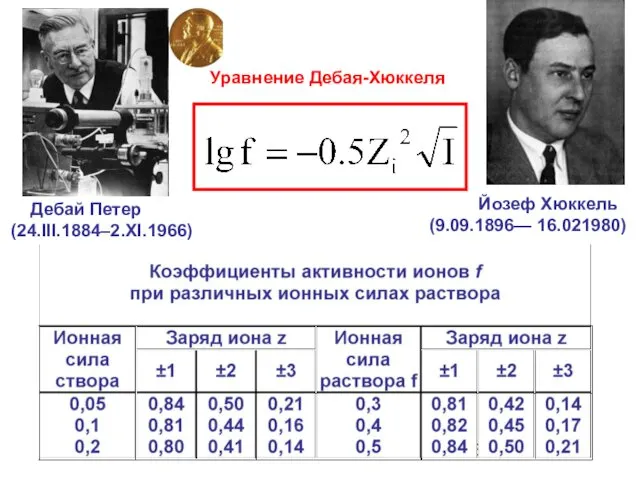
- 27. Ионная сила растворов Ионная сила растворов - величина, измеряемая полусуммой произведений концентраций всех находящихся в растворе
- 28. Уравнение Дебая-Хюккеля Дебай Петер (24.III.1884–2.XI.1966) Йозеф Хюккель (9.09.1896— 16.021980)
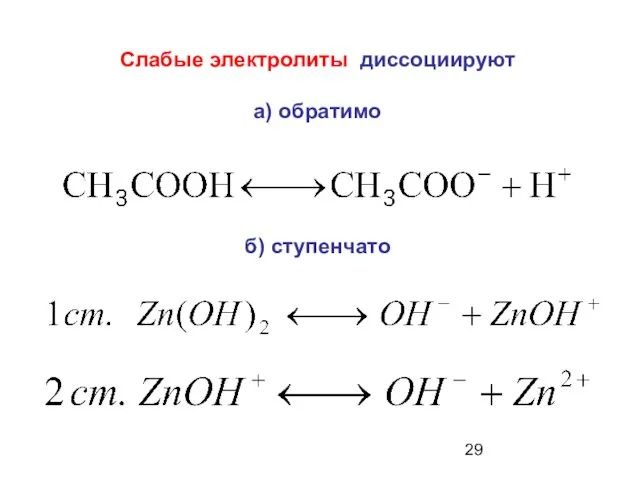
- 29. Слабые электролиты диссоциируют а) обратимо б) ступенчато
- 30. Степень диссоциации (ионизации) - отношение числа молекул, распавшихся на ионы, к общему числу молекул в растворе.
- 31. Закон разведения Оствальда Нобелевская премия (1909г) « в знак признания работ по катализу, а также за
- 32. При α Вывод закона разведения Оствальда
- 33. 2. Степень диссоциации кислоты HX равна 0,25. Какое суммарное число ионов H+ и X- приходится в
- 34. Расчет рН в растворах сильных электролитах Рассчитать рН, рОН, [OH-] для 0,001 м НNO3 рН =
- 35. Задача 1. рН яблочного сока равен 4,57. Найти [Н+] и [OH-] (моль/л). рОН = 14 -
- 37. Расчет [ Н+] и рН для растворов слабых электролитов Кислоты Смесь кислот
- 38. Для смеси оснований Основания
- 39. Задача 2. Найти рН, [Н+] и [OH-] 0,3 м раствора муравьиной кислоты (Кд=1.8∙10-4) рН = –
- 40. Общая, активная и потенциальная кислотность Активная кислотность – концентрация свободных катионов Н+, имеющихся в растворе при
- 43. Скачать презентацию




















![Расчет рН в растворах сильных электролитах Рассчитать рН, рОН, [OH-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52326/slide-33.jpg)
![Задача 1. рН яблочного сока равен 4,57. Найти [Н+] и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52326/slide-34.jpg)

![Расчет [ Н+] и рН для растворов слабых электролитов Кислоты Смесь кислот](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52326/slide-36.jpg)

![Задача 2. Найти рН, [Н+] и [OH-] 0,3 м раствора](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52326/slide-38.jpg)


 Психопатии. Типы личностных расстройств
Психопатии. Типы личностных расстройств Русская Классическая Школа педагогическая стратегия будущего, проверенная великим образовательным прошлым
Русская Классическая Школа педагогическая стратегия будущего, проверенная великим образовательным прошлым Технологія жирів і жирозамінників
Технологія жирів і жирозамінників Кроссворд по теме: “Революция в Англии”
Кроссворд по теме: “Революция в Англии” Монтаж дифференцированного автоматического выключателя АВВ 40 А
Монтаж дифференцированного автоматического выключателя АВВ 40 А Патофизиология сосудистого тонуса
Патофизиология сосудистого тонуса Циклы. Цикл с фиксированным числом операций for
Циклы. Цикл с фиксированным числом операций for Внеурочное занятие в 5 Б классе. Доброта спасет мир!
Внеурочное занятие в 5 Б классе. Доброта спасет мир! Разработанные самостоятельно ЭОР Загадки о домашних животных
Разработанные самостоятельно ЭОР Загадки о домашних животных Защитник - односельчанин.
Защитник - односельчанин. Презентация по сенсорике на 1 категорию
Презентация по сенсорике на 1 категорию Социальное партнёрство с родителями, как условие развития творческих способностей обучающихся
Социальное партнёрство с родителями, как условие развития творческих способностей обучающихся  Автоматизация бизнеса и онлайн продажи
Автоматизация бизнеса и онлайн продажи Цветик-семицветик
Цветик-семицветик Здоровьесберегающие технологии в работе музыкального руководителя (из опыта работы).
Здоровьесберегающие технологии в работе музыкального руководителя (из опыта работы). Приключенческий туризм
Приключенческий туризм Российский стандарт профессиональной деятельности архитектора. (Лекция 9)
Российский стандарт профессиональной деятельности архитектора. (Лекция 9) приложение к мониторингу
приложение к мониторингу Структура производственного процесса
Структура производственного процесса Nothing is forever
Nothing is forever Творческий проект в школе
Творческий проект в школе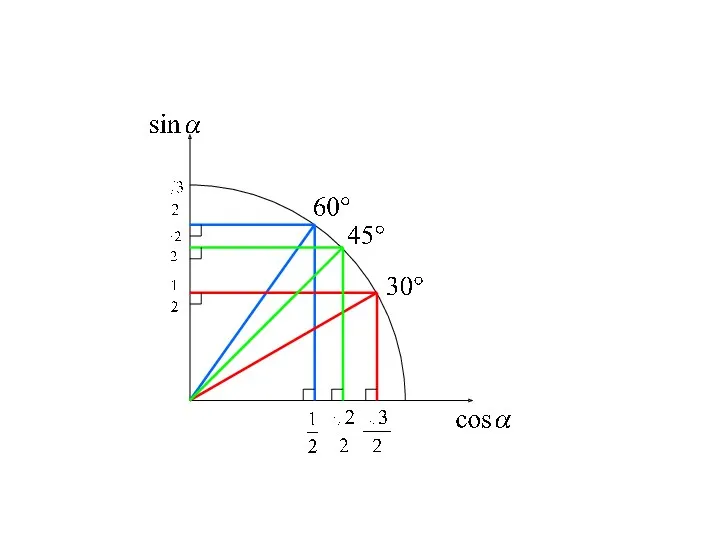 Презентация КРУГ для 9А
Презентация КРУГ для 9А Крытая спортивная площадка с модульным пневматическим тиром для жителей Московского района Санкт-Петербурга
Крытая спортивная площадка с модульным пневматическим тиром для жителей Московского района Санкт-Петербурга Искусство периода Великой Отечественной Войны
Искусство периода Великой Отечественной Войны Что такое текст?
Что такое текст? Николай Николаевич Носов
Николай Николаевич Носов Интерактивная игра Живая и неживая природа
Интерактивная игра Живая и неживая природа Тест в программе Power Point - Классы неорганических соединений
Тест в программе Power Point - Классы неорганических соединений