Содержание
- 2. Для гомогенных реакций. Скорость химической реакции- это изменение концентрации одного из реагирующих веществ или одного из
- 3. Для гетерогенных реакций. Скорость определяется изменением количества вещества в единицу времени на единице поверхности твёрдого вещества.
- 4. Факторы, влияющие на скорость реакций. 1.Природа реагирующих веществ. 2.Концентрация веществ. 3.Площадь соприкосновения реагирующих веществ. 4.Температура. 5.Катализатор.
- 5. Природа реагирующих веществ 1)Взаимодействие Na и K с водой. 2)Взаимодействие галогенов с алюминием или водородом. Скорость
- 6. Концентрация веществ. (в растворённом или газообразном состоянии) 1)Горение серы на воздухе или в чистом кислороде. 2)Взаимодействие
- 7. Площадь поверхности соприкосновения реагирующих веществ. (для гетерогенных реакций) Пример: взаимодействие соляной кислоты с Zn в виде
- 8. Температура. Пример реакции CuO c HCl при комнатной температуре и нагревании. При повышении температуры на каждые10º
- 9. Катализатор. Катализаторы- это вещества, которые изменяют скорость реакции, оставаясь к концу её неизменными. Пример: разложение перекиси
- 10. Давление Только если участвуют в реакции газы С повышением давления скорость увеличивается С повышением давления расстояние
- 11. Вопросы для закрепления 1. Скорость гомогенной химической реакции пропорциональна изменению 1) концентрации вещества в единицу времени
- 12. 2. Под скоростью химической реакции понимают изменение 1) концентрации реагента в единицу времени 2) количества вещества
- 13. 3. Согласно правилу Вант-Гоффа при повышении температуры на 10 К скорость многих реакций: 1) увеличивается в
- 14. 4.Для уменьшения скорости химической реакции необходимо: 1) увеличить концентрацию реагирующих веществ 2) ввести в систему катализатор
- 15. 5.Для увеличения скорости взаимодействия железа с хлороводородной (соляной) кислотой следует 1) добавить ингибитор 2) понизить температуру
- 17. Скачать презентацию














 Выступление на Новый год Сказка в Новогоднюю ночь
Выступление на Новый год Сказка в Новогоднюю ночь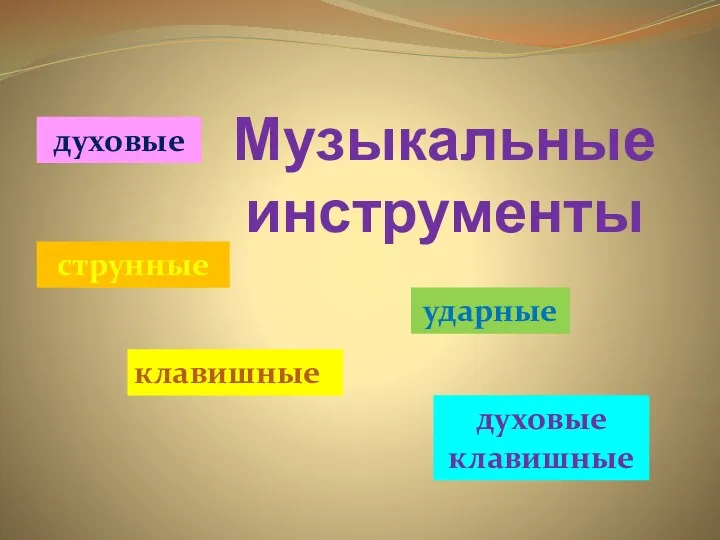 Презентация музыкальные инструменты
Презентация музыкальные инструменты Методическая разработка раздела образовательной программы по футболу Тактическая и техническая подготовка футболистов 7-9 лет
Методическая разработка раздела образовательной программы по футболу Тактическая и техническая подготовка футболистов 7-9 лет Деловой этикет в профессиональной деятельности педагога.
Деловой этикет в профессиональной деятельности педагога.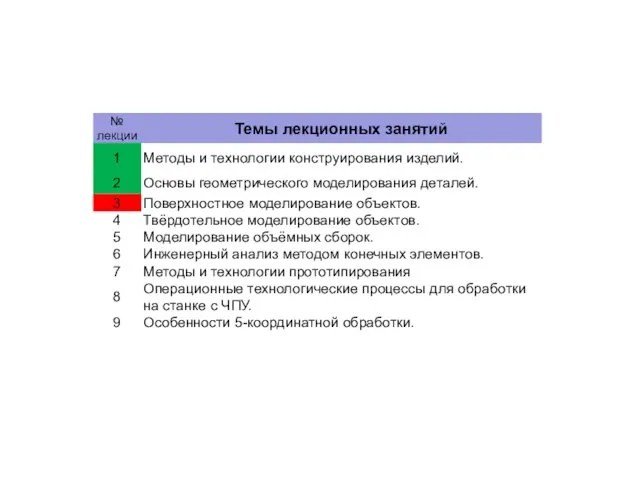 Методы и технологии конструирования изделий. Поверхностное моделирование объектов. (Лекция 3)
Методы и технологии конструирования изделий. Поверхностное моделирование объектов. (Лекция 3) Сравнение стандартов 2004 г. и ФГОС второго поколения. Изменения в содержании образования и в подходах к преподаванию.
Сравнение стандартов 2004 г. и ФГОС второго поколения. Изменения в содержании образования и в подходах к преподаванию. Страны Евразии. Обобщение. Задания
Страны Евразии. Обобщение. Задания Пиломатериалы. Виды и классификация пиломатериалов
Пиломатериалы. Виды и классификация пиломатериалов Строгание. Виды рубанков
Строгание. Виды рубанков Семинар-тренинг по подготовке к квалификационному экзамену по направлению движимое имущество
Семинар-тренинг по подготовке к квалификационному экзамену по направлению движимое имущество Богоматерь Владимирская. Первая треть XII в
Богоматерь Владимирская. Первая треть XII в Проективный графический тест Дерево
Проективный графический тест Дерево Презентация по методической теме: Балаларда туган җиребезгә мәхәббәт, аның табигатенә карата сакчыл караш тәрбияләү һәм экологик тәрбия бирү 2011-2015 год
Презентация по методической теме: Балаларда туган җиребезгә мәхәббәт, аның табигатенә карата сакчыл караш тәрбияләү һәм экологик тәрбия бирү 2011-2015 год Подбор сечения балки КМ. Прокатное сечение
Подбор сечения балки КМ. Прокатное сечение Средства для похудения
Средства для похудения Работа с семьей воспитанника с расстройством аутистического спектра (РАС)
Работа с семьей воспитанника с расстройством аутистического спектра (РАС) Презентация мини-музея Русская изба с детьми старшего дошкольного возраста
Презентация мини-музея Русская изба с детьми старшего дошкольного возраста Основы строения органических соединений
Основы строения органических соединений тест оксиды
тест оксиды Образ России в искусстве. Виды изобразительного искусства
Образ России в искусстве. Виды изобразительного искусства Сущ
Сущ Музыкальное развитие ребенка. Презентация.
Музыкальное развитие ребенка. Презентация. ИжГТУ имени М. Т. Калашникова. Итоги учебного года 2019/2020 и задачи нового учебного года
ИжГТУ имени М. Т. Калашникова. Итоги учебного года 2019/2020 и задачи нового учебного года 20230921_frazeologizmeher_0
20230921_frazeologizmeher_0 Мемориал Хатынь
Мемориал Хатынь Чем занять детей дома
Чем занять детей дома Шаблон Фракталы-25
Шаблон Фракталы-25 Внутренняя политика Александра I в 1815 – 1825
Внутренняя политика Александра I в 1815 – 1825