Содержание
- 2. Цели лекции: Обучающая - Сформировать знания о строении, номенклатуре и классификации органических соединений. Развивающая – Расширить
- 3. Предмет органической химии Органическая химия – научная дисциплина, изучающая органические соединения. Органические соединения – это углеводороды
- 4. Предмет органической химии
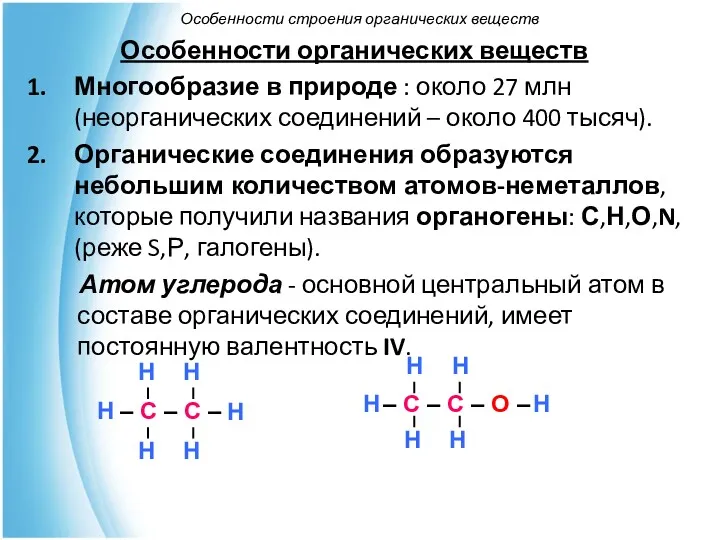
- 5. Особенности органических веществ Многообразие в природе : около 27 млн (неорганических соединений – около 400 тысяч).
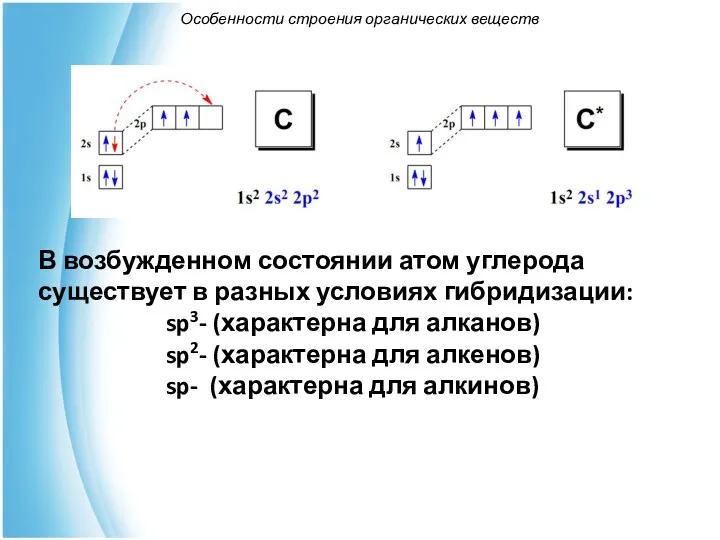
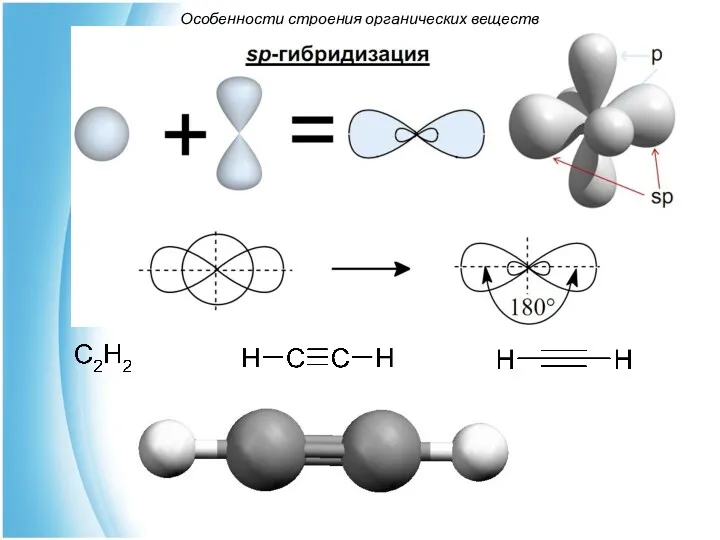
- 6. Особенности строения органических веществ В возбужденном состоянии атом углерода существует в разных условиях гибридизации: sp3- (характерна
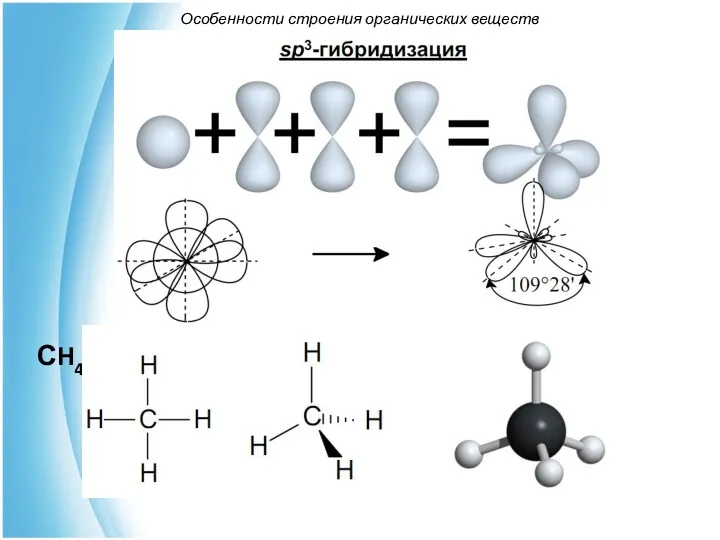
- 7. СH4 Особенности строения органических веществ
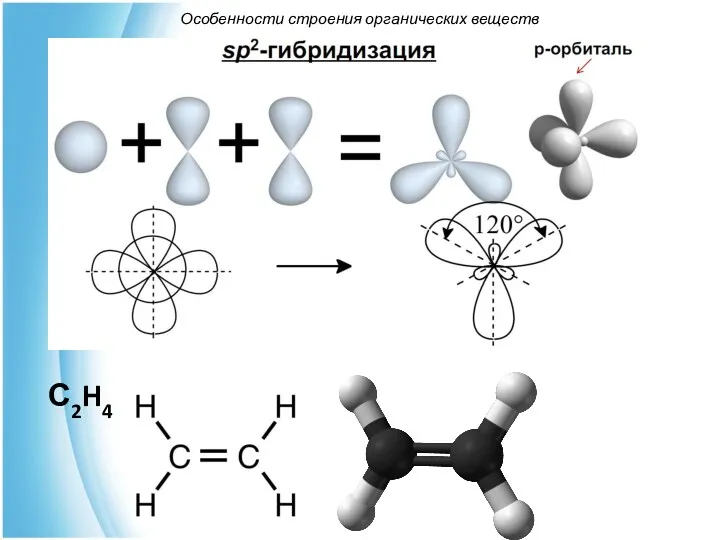
- 8. С2H4 Особенности строения органических веществ
- 9. Особенности строения органических веществ
- 10. Органические соединения имеют молекулярное строение. Основной тип химической связи – ковалентная: Неполярная (С-С) Слабополярная (С-H) Полярная
- 11. Неполярная ковалентная связь: Образуется между атомами одного элемента; Нет разности в электроотрицательности; Общая электронная пара находится
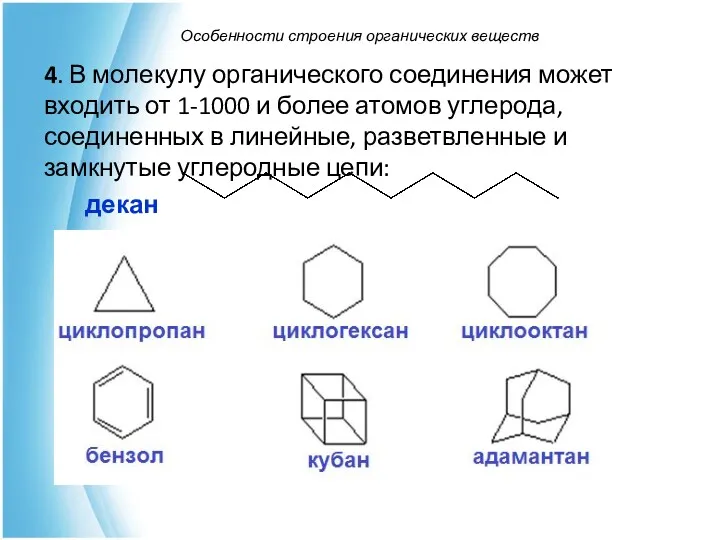
- 12. Особенности строения органических веществ 4. В молекулу органического соединения может входить от 1-1000 и более атомов
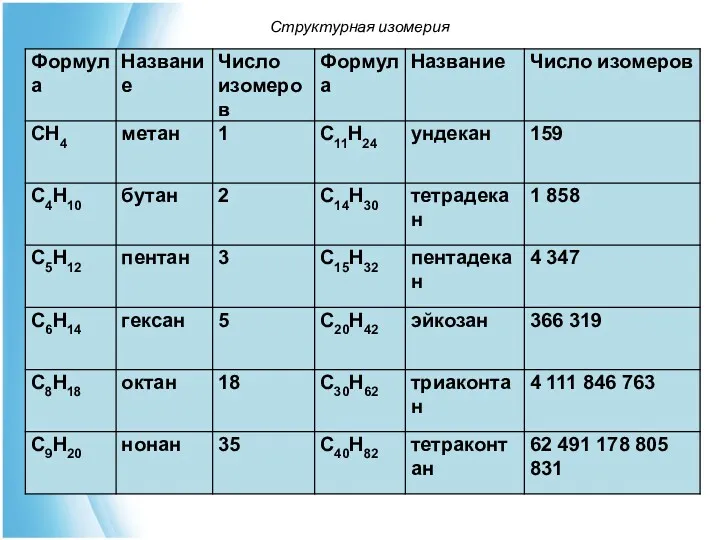
- 13. Для органических веществ характерна изомерия. Изомеры – вещества имеющие одинаковый состав, но разное химическое строение (структурная
- 14. Особенности строения органических веществ Изомерия Структурная Стереоизомерия (пространственная изомерия) Диастереомерия Энантиомерия
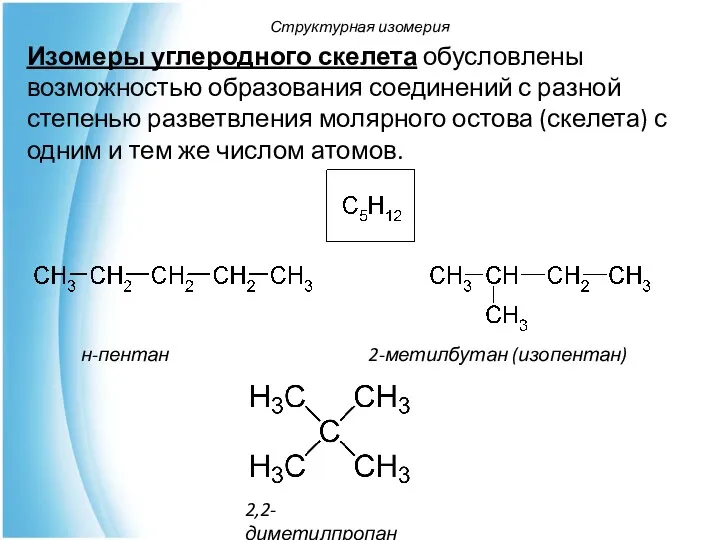
- 15. Структурная изомерия Структурные изомеры – изомеры, отличающиеся химическим строением и, следовательно, химическими свойствами. Различают изомерию: углеродного
- 16. Изомеры углеродного скелета обусловлены возможностью образования соединений с разной степенью разветвления молярного остова (скелета) с одним
- 17. Структурная изомерия
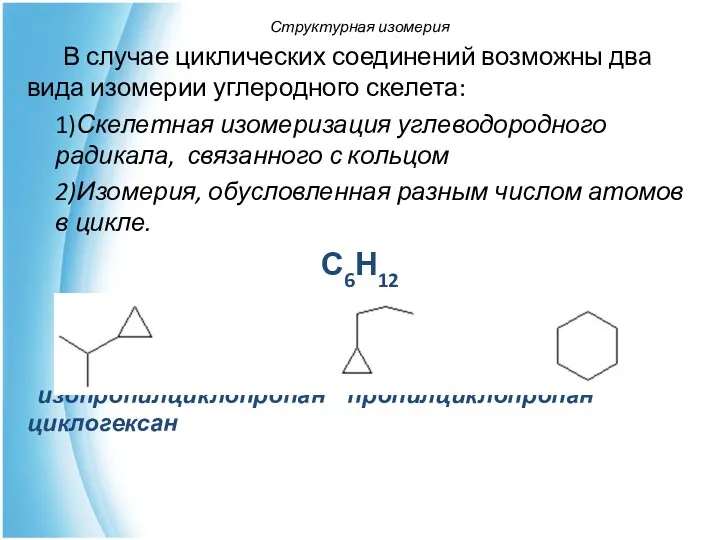
- 18. В случае циклических соединений возможны два вида изомерии углеродного скелета: 1)Скелетная изомеризация углеводородного радикала, связанного с
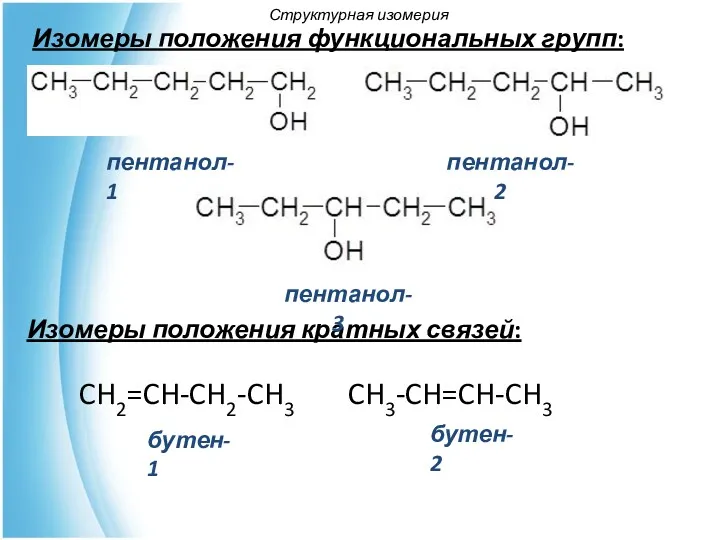
- 19. Изомеры положения функциональных групп: Изомеры положения кратных связей: пентанол-1 бутен-1 бутен-2 CH2=CH-CH2-CH3 пентанол-2 пентанол-3 CH3-CH=CH-CH3 Структурная
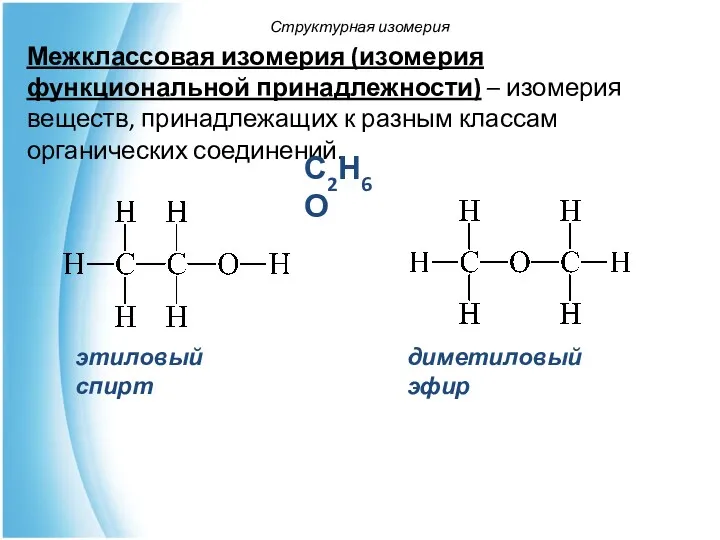
- 20. Межклассовая изомерия (изомерия функциональной принадлежности) – изомерия веществ, принадлежащих к разным классам органических соединений. Структурная изомерия
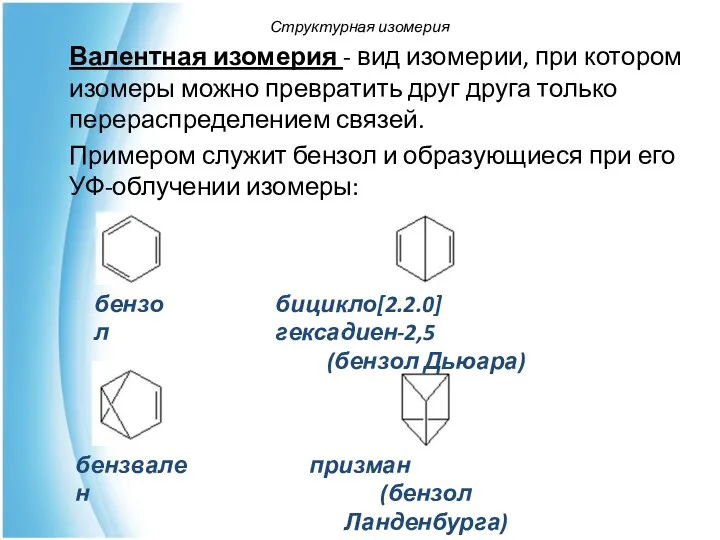
- 21. Валентная изомерия - вид изомерии, при котором изомеры можно превратить друг друга только перераспределением связей. Примером
- 22. Для удобства изучения по свойствам и строению органические вещества объединяют в гомологические ряды. Гомологи – вещества
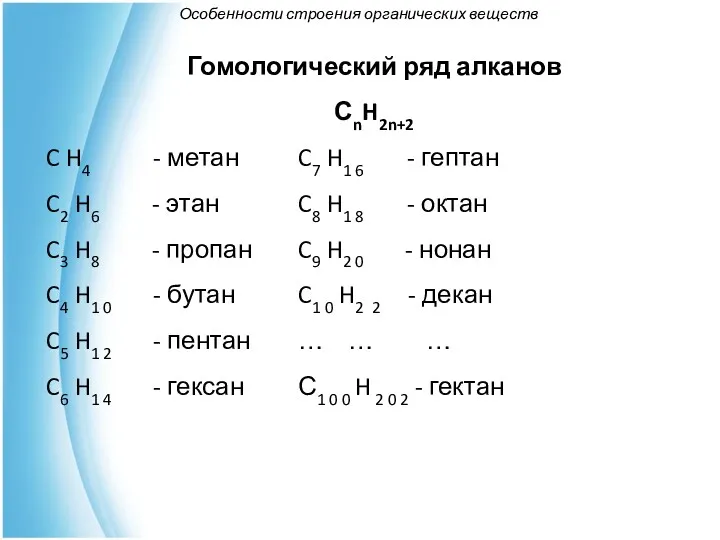
- 23. Особенности строения органических веществ Гомологический ряд алканов СnH2n+2 C H4 - метан C7 H1 6 -
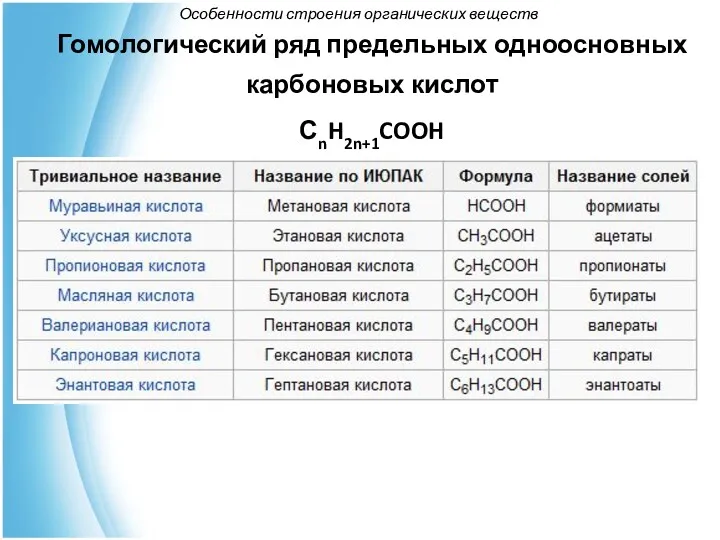
- 24. Особенности строения органических веществ Гомологический ряд предельных одноосновных карбоновых кислот СnH2n+1COOH
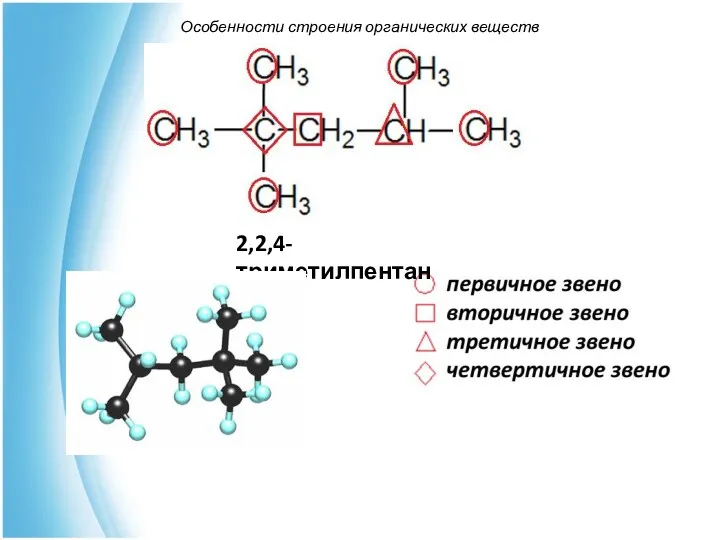
- 25. Особенности строения органических веществ 7. Атомы углерода (углеродные звенья) в углеродной цепи могут быть первичными, вторичными,
- 26. Особенности строения органических веществ 2,2,4-триметилпентан
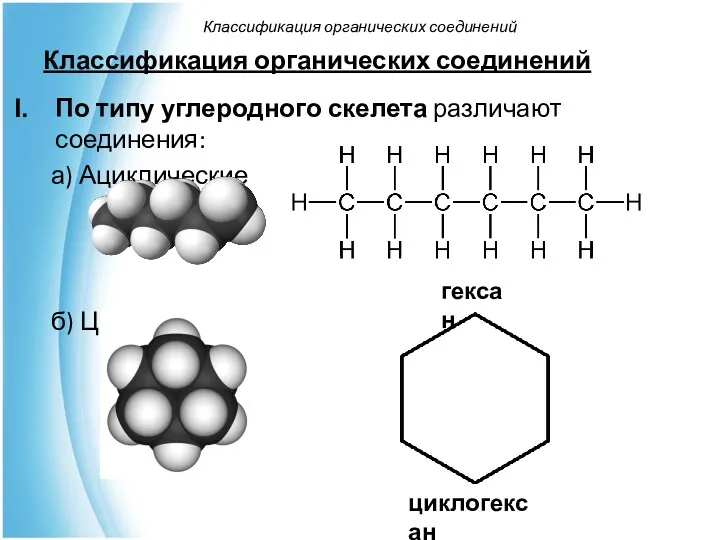
- 27. По типу углеродного скелета различают соединения: а) Ациклические б) Циклические Классификация органических соединений Классификация органических соединений
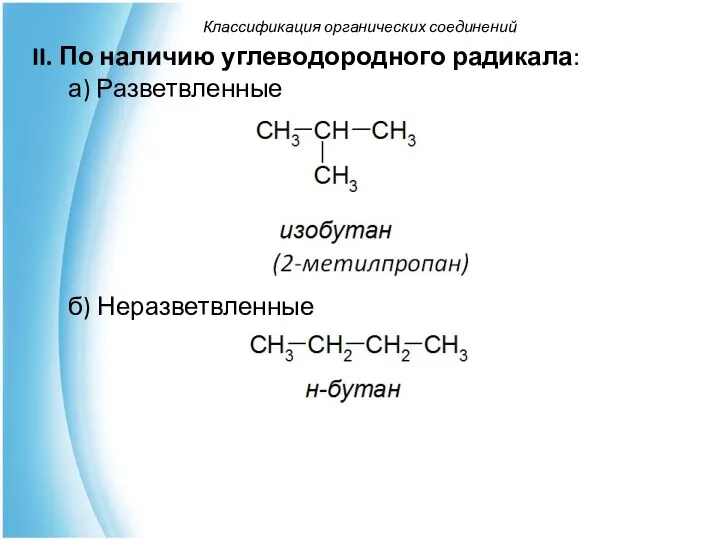
- 28. Классификация органических соединений II. По наличию углеводородного радикала: а) Разветвленные б) Неразветвленные
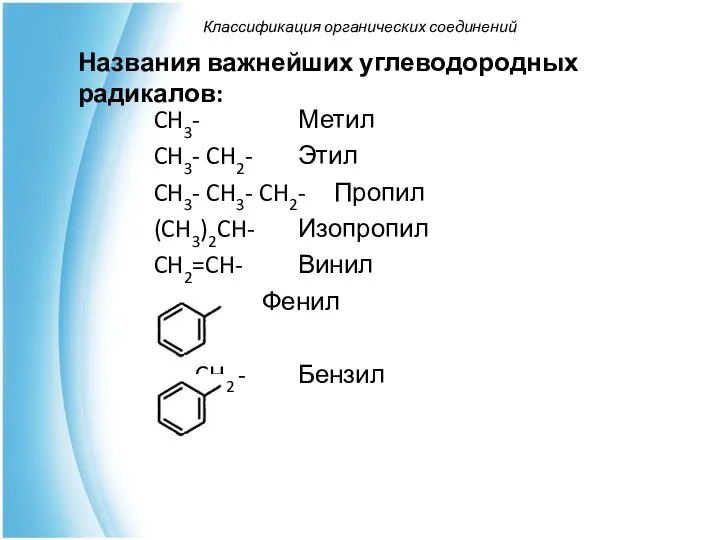
- 29. Классификация органических соединений Названия важнейших углеводородных радикалов: CH3- Метил CH3- CH2- Этил CH3- CH3- CH2- Пропил
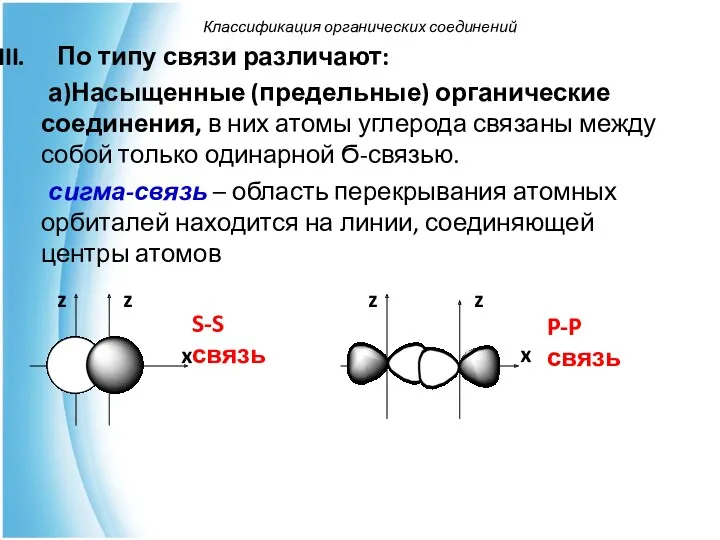
- 30. По типу связи различают: а)Насыщенные (предельные) органические соединения, в них атомы углерода связаны между собой только
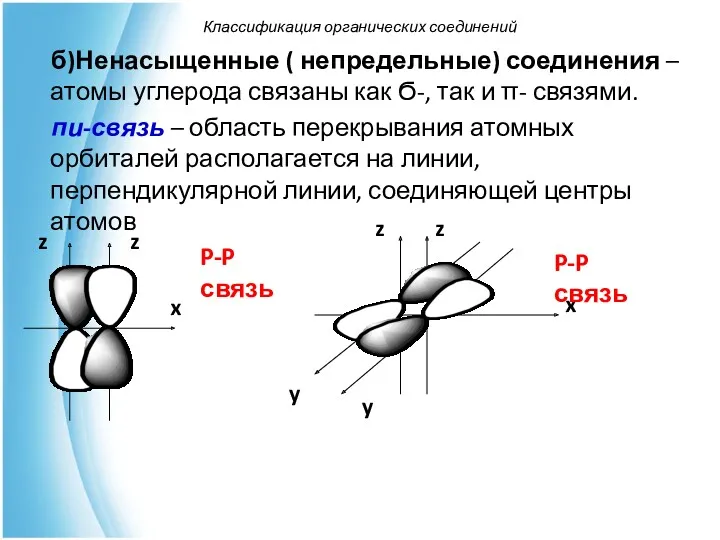
- 31. б)Ненасыщенные ( непредельные) соединения – атомы углерода связаны как Ϭ-, так и π- связями. пи-связь –
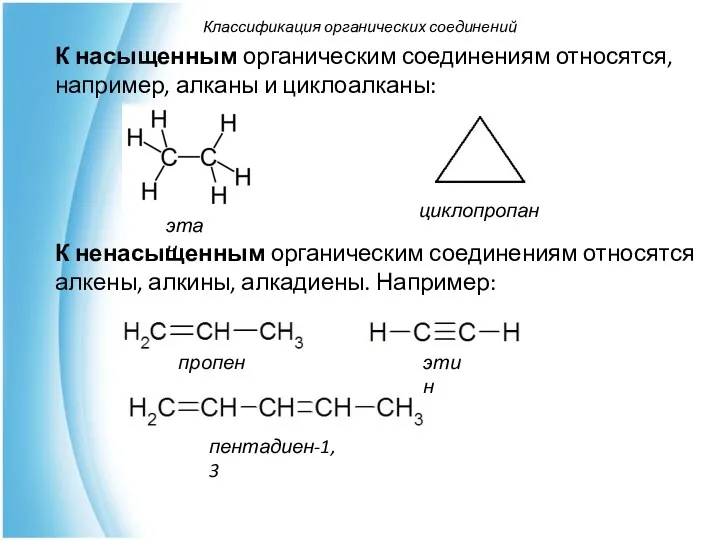
- 32. К насыщенным органическим соединениям относятся, например, алканы и циклоалканы: К ненасыщенным органическим соединениям относятся алкены, алкины,
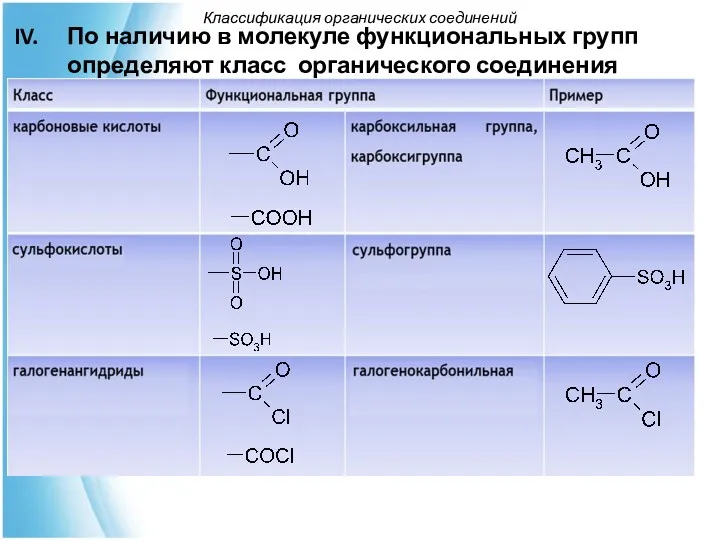
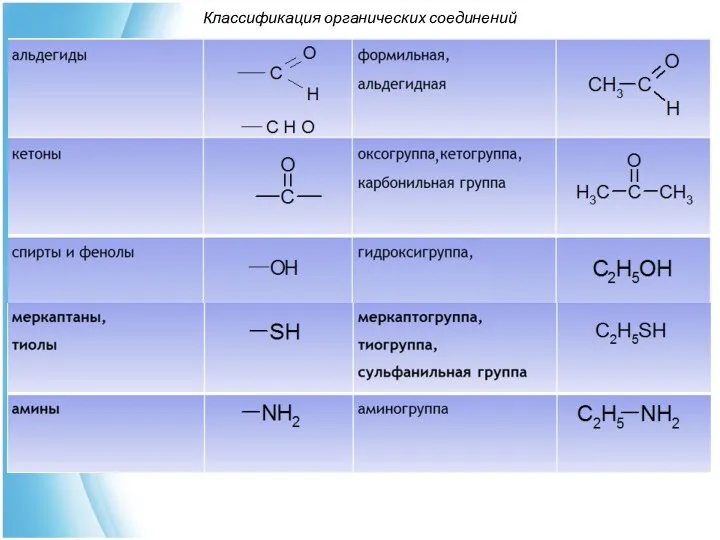
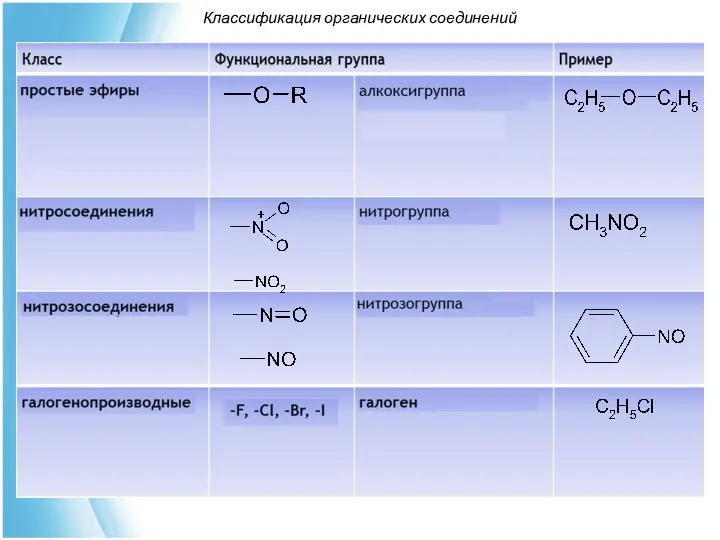
- 33. По наличию в молекуле функциональных групп определяют класс органического соединения Классификация органических соединений
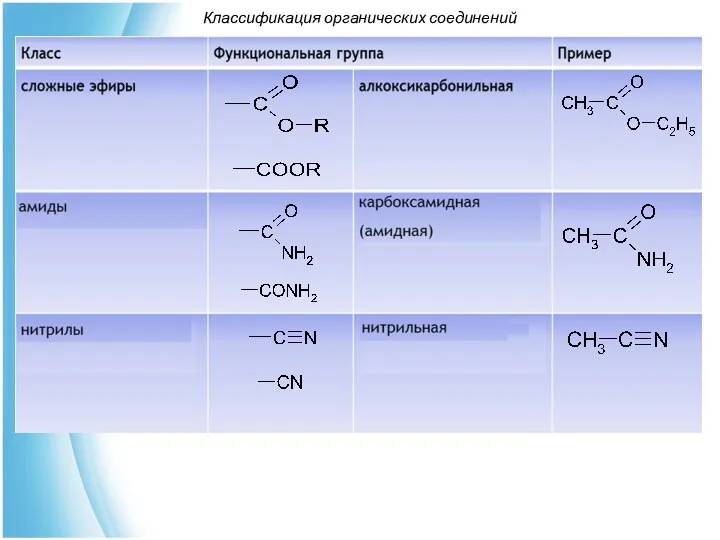
- 34. Классификация органических соединений
- 35. Классификация органических соединений
- 36. Классификация органических соединений
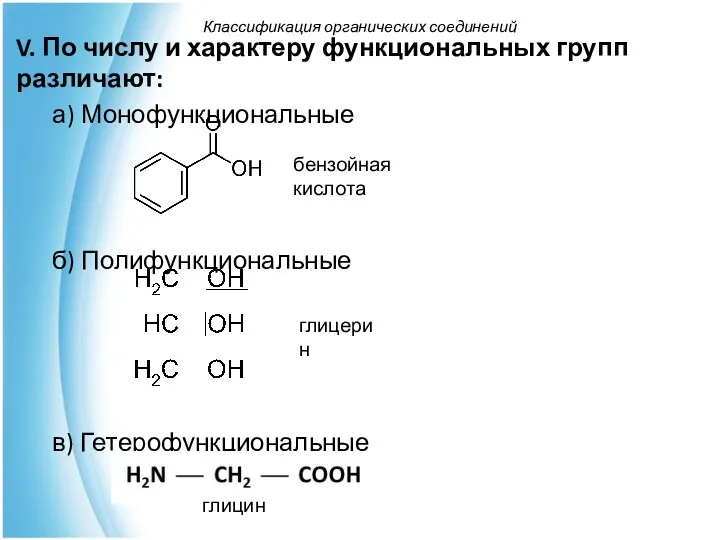
- 37. V. По числу и характеру функциональных групп различают: а) Монофункциональные б) Полифункциональные в) Гетерофункциональные Классификация органических
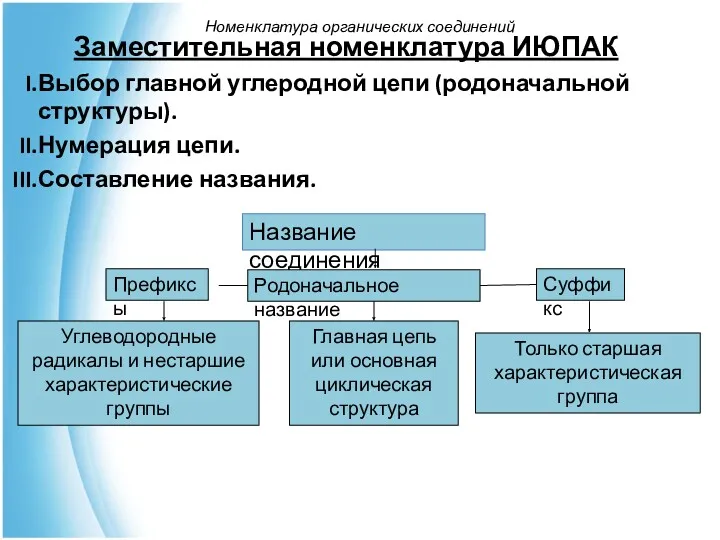
- 38. Заместительная номенклатура ИЮПАК Выбор главной углеродной цепи (родоначальной структуры). Нумерация цепи. Составление названия. Название соединения Префиксы
- 39. Номенклатура органических соединений
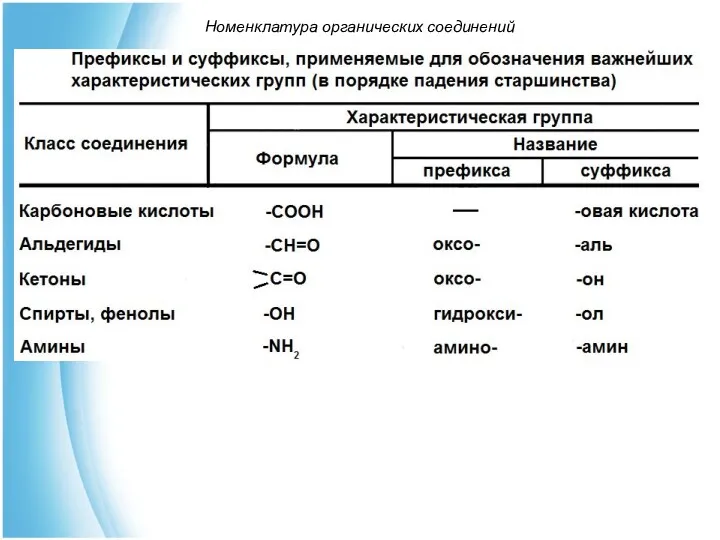
- 40. Номенклатура органических соединений Например: 1)
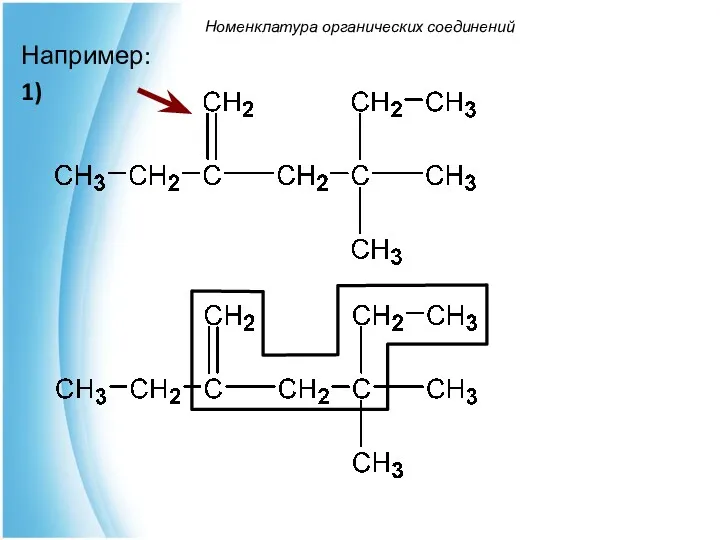
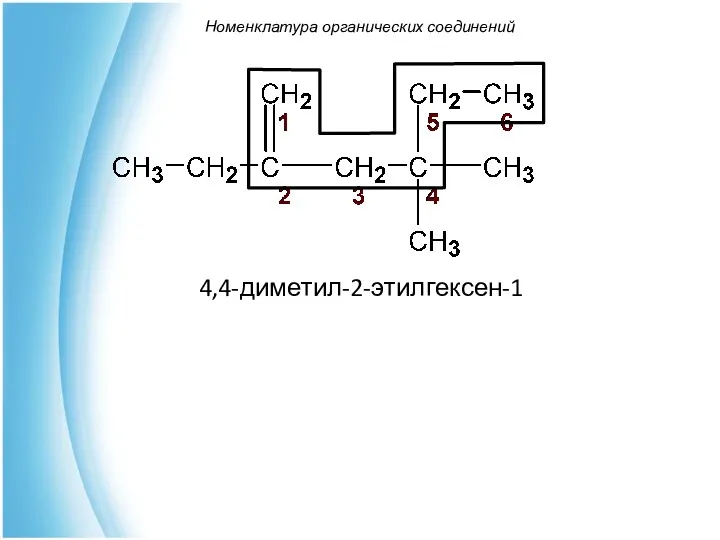
- 41. Номенклатура органических соединений 4,4-диметил-2-этилгексен-1
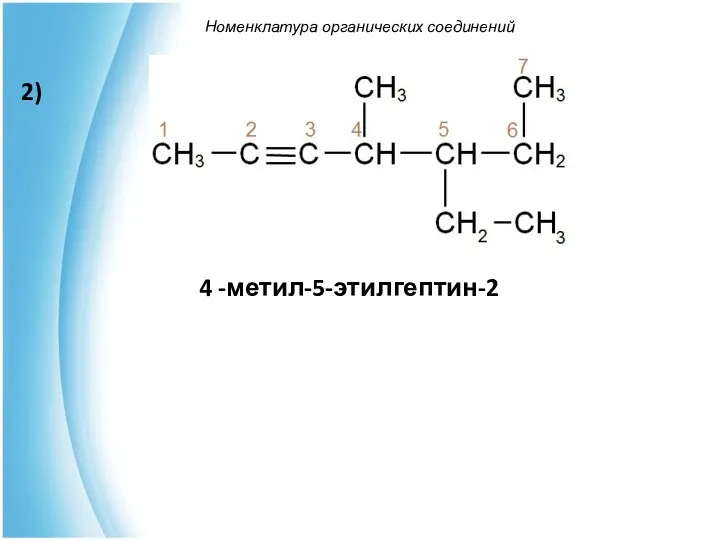
- 42. Номенклатура органических соединений 4 -метил-5-этилгептин-2 2)
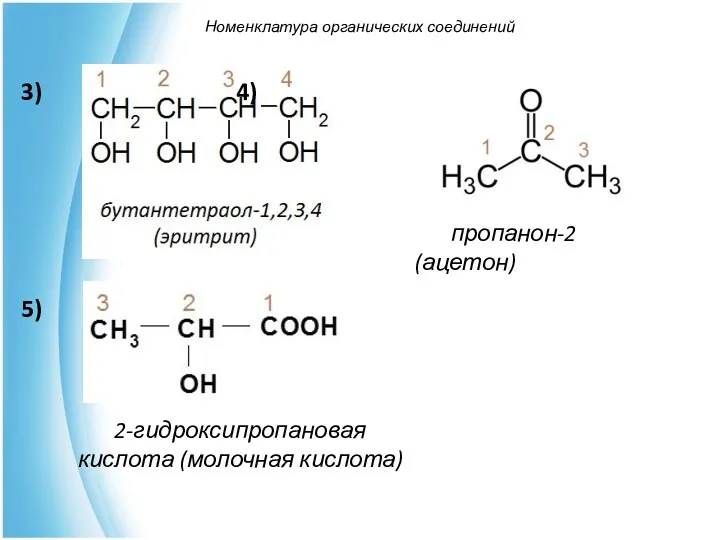
- 43. Номенклатура органических соединений пропанон-2 (ацетон) 2-гидроксипропановая кислота (молочная кислота) 3) 4) 5)
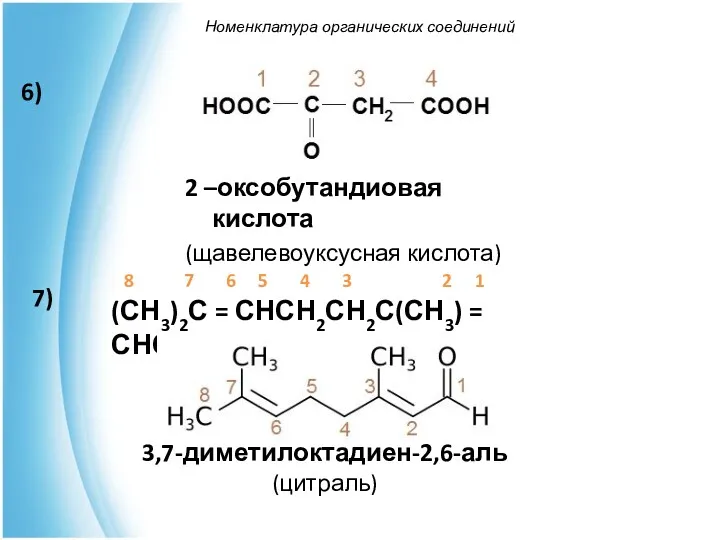
- 44. Номенклатура органических соединений 3,7-диметилоктадиен-2,6-аль (цитраль) 8 7 6 5 4 3 2 1 (СН3)2С = СНСН2СН2С(СН3)
- 45. Классификация органических реакций. Типы реагентов Основными понятиями, характеризующими реакционную способность органического вещества, являются: Субстрат – вещество,
- 46. Свободный радикал (R·) – частица с неспаренным электроном, очень реакционноспособная и короткоживущая. Электрофил (E+, Е) –
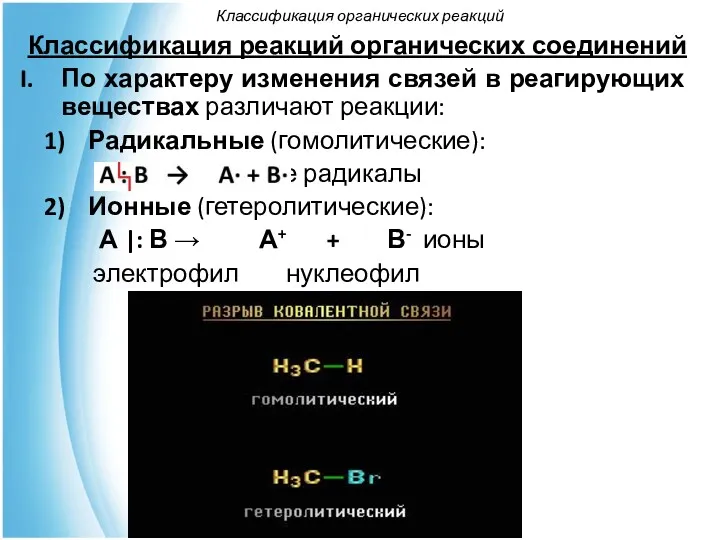
- 47. Классификация реакций органических соединений По характеру изменения связей в реагирующих веществах различают реакции: Радикальные (гомолитические): свободные
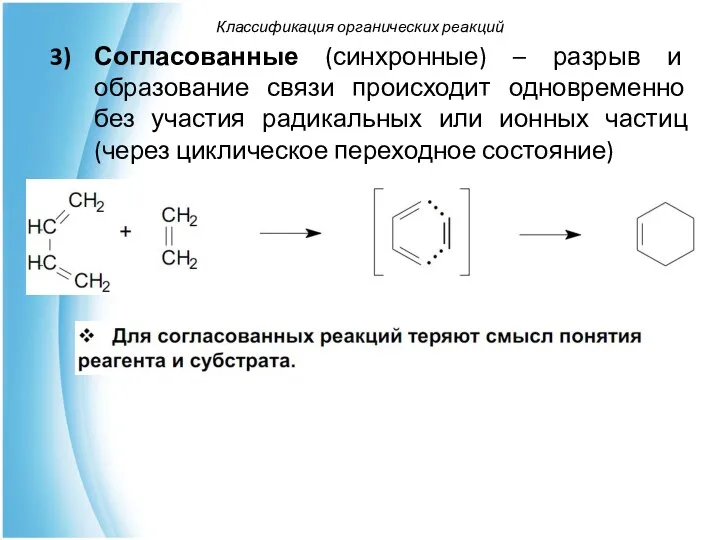
- 48. Согласованные (синхронные) – разрыв и образование связи происходит одновременно без участия радикальных или ионных частиц (через
- 49. По направлению (по конечному результату), т.е. по тем изменениям, которые происходят в субстрате различают: Реакции замещения
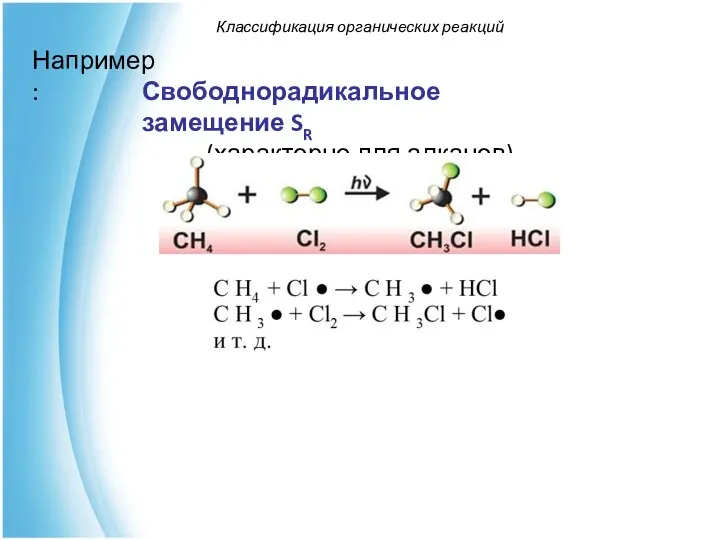
- 50. Классификация органических реакций Например: Свободнорадикальное замещение SR (характерно для алканов)
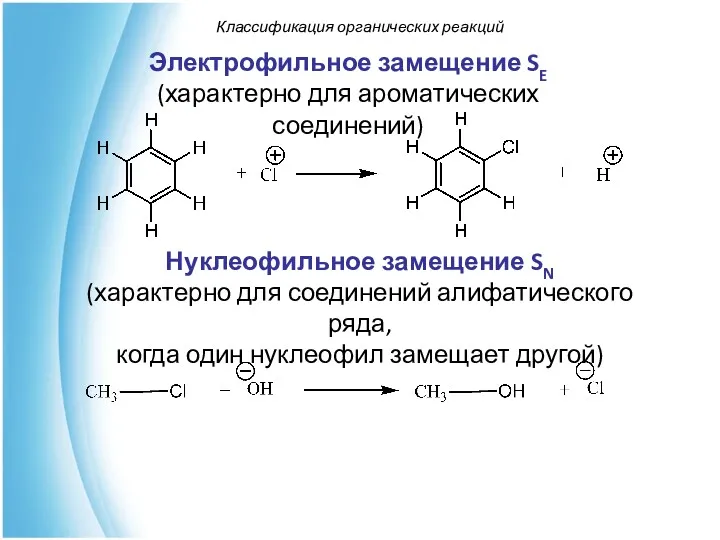
- 51. Электрофильное замещение SE (характерно для ароматических соединений) Классификация органических реакций Нуклеофильное замещение SN (характерно для соединений
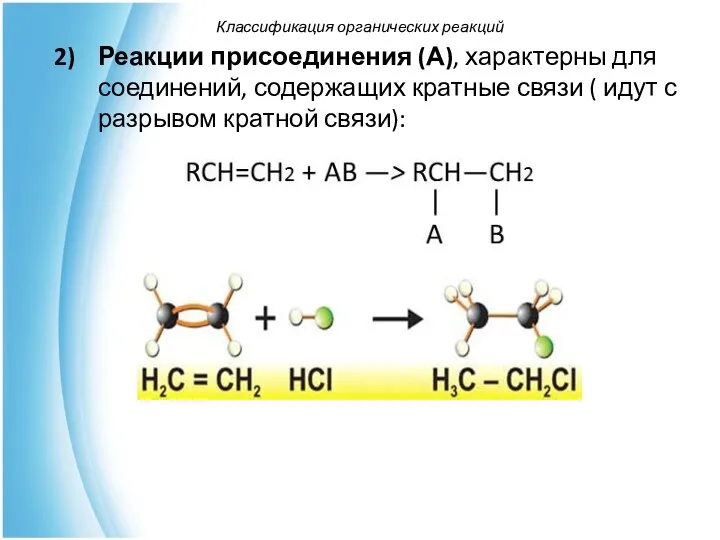
- 52. Реакции присоединения (А), характерны для соединений, содержащих кратные связи ( идут с разрывом кратной связи): Классификация
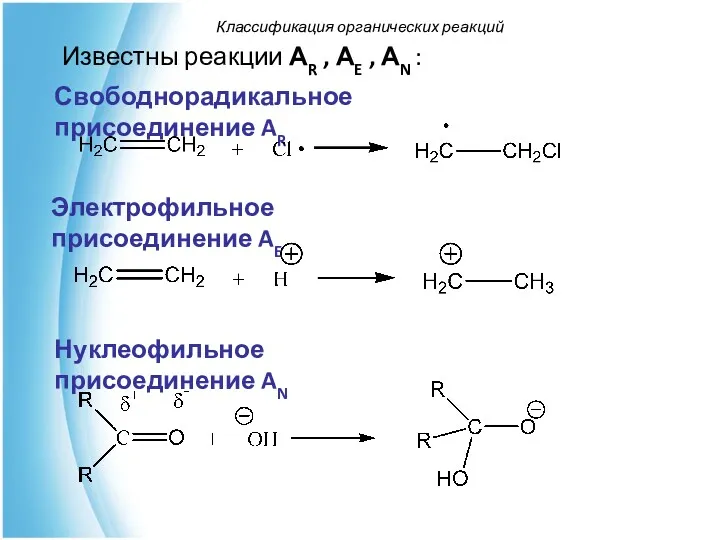
- 53. Известны реакции АR , АE , АN : Классификация органических реакций Электрофильное присоединение AE Нуклеофильное присоединение
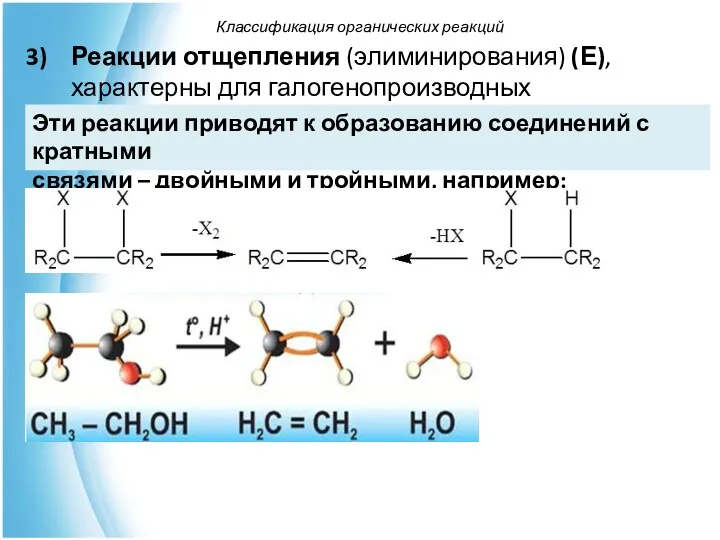
- 54. Реакции отщепления (элиминирования) (Е), характерны для галогенопроизводных углеводородов и спиртов. Классификация органических реакций Эти реакции приводят
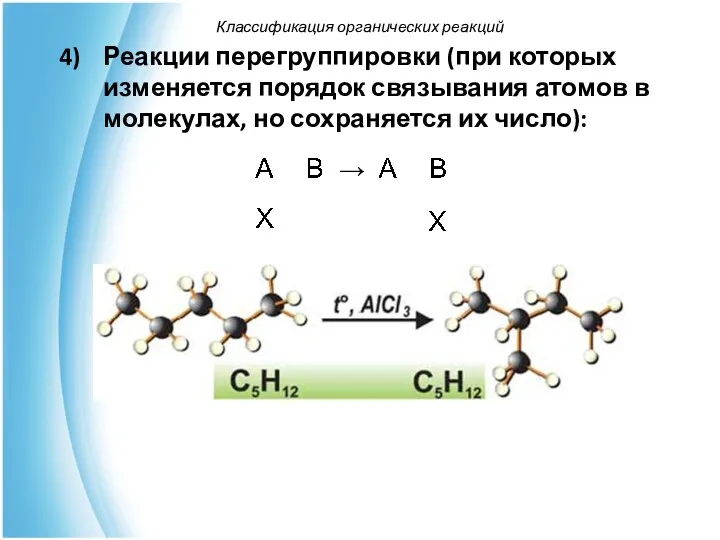
- 55. Реакции перегруппировки (при которых изменяется порядок связывания атомов в молекулах, но сохраняется их число): Классификация органических
- 56. Реакции восстановления ([Н]), характерны для непредельных соединений, а также альдегидов и кетонов. Например: Реакции окисления ([O]),
- 57. По числу молекул, принимающих участие в стадии, определяющей скорость реакции различают: Мономолекулярные реакции – участвуют молекулы
- 58. В ходе химического превращения обычно затрагивается не вся молекула, а только ее часть – реакционный центр.
- 60. Скачать презентацию












![Реакции восстановления ([Н]), характерны для непредельных соединений, а также альдегидов и кетонов. Например:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/52319/slide-55.jpg)


 Функціональні матеріали для високоенергетичної електроніки
Функціональні матеріали для високоенергетичної електроніки Михаил Иванович Глинка
Михаил Иванович Глинка Алюминиевые системы Schüco
Алюминиевые системы Schüco Увертюра - фантазия П.И Чайковского Ромео и Джульетта
Увертюра - фантазия П.И Чайковского Ромео и Джульетта Техника безопасности на уроках физической культуры
Техника безопасности на уроках физической культуры Информирование родителей по вопросам воспитания детей как средство совершенствования педагогической культуры
Информирование родителей по вопросам воспитания детей как средство совершенствования педагогической культуры Битки по київські
Битки по київські Энергетика для неэнергетиков
Энергетика для неэнергетиков Смольный институт благородных девиц
Смольный институт благородных девиц Автоматические устройства
Автоматические устройства Углы и отрезки, связанные с окружностью. 10 класс
Углы и отрезки, связанные с окружностью. 10 класс Акции. Бытхимия
Акции. Бытхимия Характеристика литературного процесса начала 20 века. Многообразие литературных направлений, стилей, школ, групп
Характеристика литературного процесса начала 20 века. Многообразие литературных направлений, стилей, школ, групп Производственный менеджмент часть 1 (1)
Производственный менеджмент часть 1 (1) Как происходило объединение Франции
Как происходило объединение Франции Русский язык, как родной. Об изменении в ФЗ Об образовании в Российской Федерации
Русский язык, как родной. Об изменении в ФЗ Об образовании в Российской Федерации Презентация Пингвин
Презентация Пингвин 70-лет Сталинградской битве
70-лет Сталинградской битве ПРЕЗЕНТАЦИЯ д/о ТРАКТОРИСТ
ПРЕЗЕНТАЦИЯ д/о ТРАКТОРИСТ Самостійна робота учнів - засіб розвитку пізнавальної активності і творчого мислення
Самостійна робота учнів - засіб розвитку пізнавальної активності і творчого мислення Измерение расхода газа, пара и жидкости в производственных условиях. Расходомеры
Измерение расхода газа, пара и жидкости в производственных условиях. Расходомеры Новая система диет в лечебном питании
Новая система диет в лечебном питании Искусство в Древнем Египте
Искусство в Древнем Египте Panasonic Live Production Suite (LPS)
Panasonic Live Production Suite (LPS) Сетевое взаимодействие
Сетевое взаимодействие Токарно-винторезный станок 16К20
Токарно-винторезный станок 16К20 Жизнь птиц и зверей
Жизнь птиц и зверей презентация к уроку технологии ( 8 марта)
презентация к уроку технологии ( 8 марта)