Содержание
- 2. Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства. Получение и химические свойства. Строение
- 3. Р заряд ядра= +15 31P Электронная конфигурация: Р Р* (стационарное) (возбужденное) 1s22s2 2p6 3s1 3p3 3d1
- 4. Фосфин и фосфиды
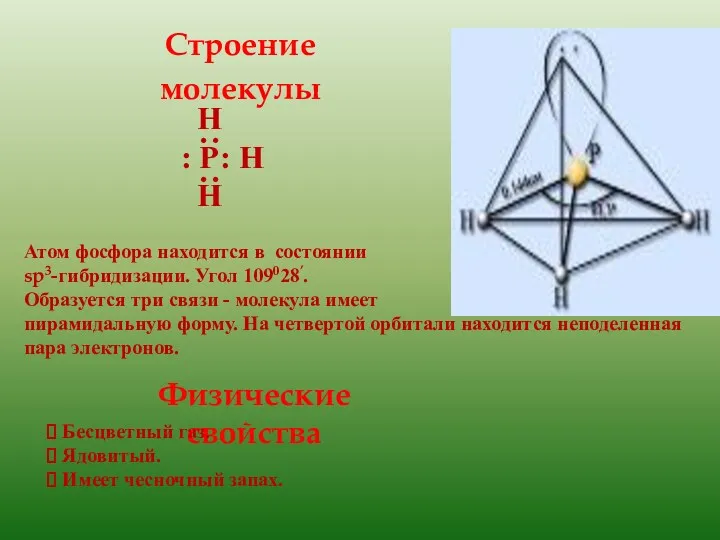
- 5. Н : Р: Н Н ∙∙ ∙∙ Атом фосфора находится в состоянии sp3-гибридизации. Угол 109028’. Образуется
- 6. Получение фосфина Получают фосфин действием воды на фосфид кальция: 3Са + 2Р = Са3Р2 Са3Р2 +
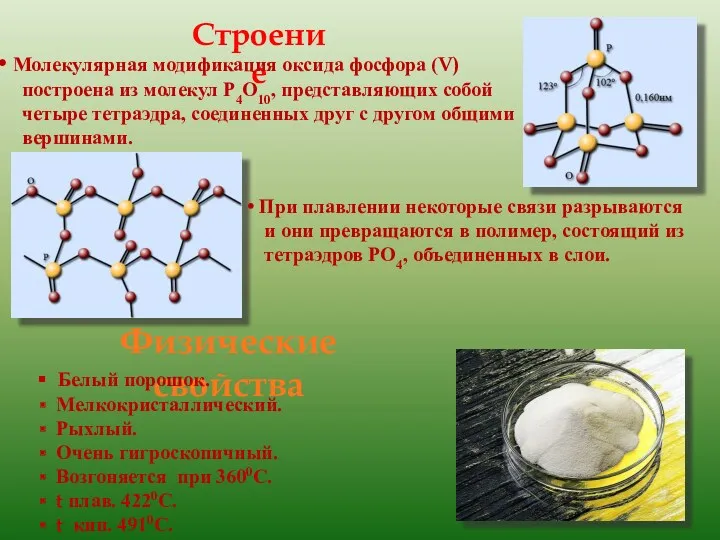
- 7. Оксид фосфора(V)
- 8. Физические свойства Белый порошок. Мелкокристаллический. Рыхлый. Очень гигроскопичный. Возгоняется при 3600С. t плав. 4220С. t кип.
- 9. Получение и химические свойства фосфорного ангидирида Оксид фосфора (V) образуется при сгорании фосфора: 4Р + 5О2
- 10. Фосфорная кислота
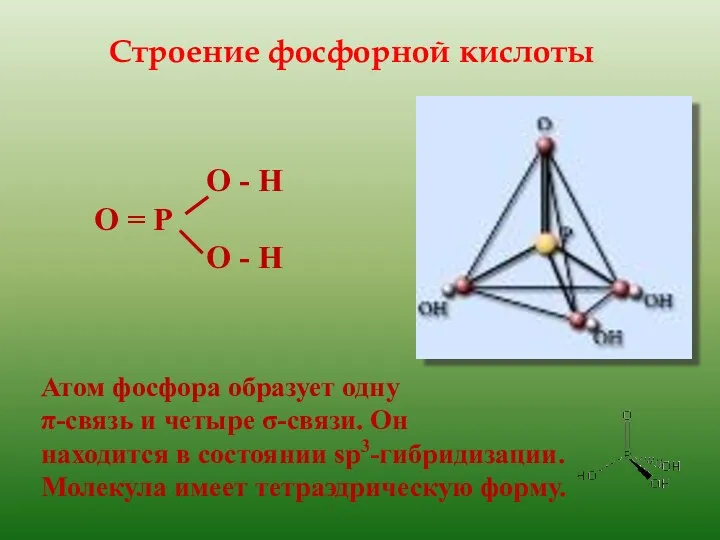
- 11. Строение фосфорной кислоты О - Н О = Р О - Н Атом фосфора образует одну
- 12. Физические свойства Бесцветные кристаллы ромбической формы. Гигроскопична. Температура плавления 42,30С. После плавления образует вязкую маслообразную жидкость
- 13. Фосфорную кислоту открыл Р. Бойль с помощью индикаторов: сжигая фосфор и растворяя образовавшийся белый продукт в
- 14. Получение Термический способ: Ca3(PO4)2 → P → P2O5 → H3PO4 Ca3(PO4)2 + 3SiO2 + 5C =
- 15. Химические свойства Диссоциирует ступенчато: H3PO4 H+ + H2PO4- К1 = 7,6∙10-3 дигидрофосфат-ион H2PO4- H+ + HPO42-
- 16. 5. Реакции с металлами тормозятся образованием нерастворимых фосфатов: 3Mg + 2H3PO4 = Mg3(PO4)2↓ + 3H2↑ При
- 17. Фосфаты - соли фосфорной кислоты Фосфаты - вещества с ионным типом кристаллической решетки. Это - твердые
- 18. Фосфорная кислота в природе Растения. Один из компонентов питания растений. Фосфор используется для построения семян и
- 19. Применение Производство минеральных удобрений: повышают урожайность; придают зимостойкость; создают условия для быстрого созревания. Производство кормовых добавок.
- 21. Скачать презентацию















 Трудности адаптации первоклассников в школе.
Трудности адаптации первоклассников в школе. Осенние именинники 2 класс
Осенние именинники 2 класс Литовская сказка Мальчик золотой хохолок и девочка золотая коса
Литовская сказка Мальчик золотой хохолок и девочка золотая коса Безусловное принятие
Безусловное принятие Виталий Бианки. Лесные домишки
Виталий Бианки. Лесные домишки Снижение рисков возникновения нарушений безопасности движения поездов при производстве маневровой и поездной работы
Снижение рисков возникновения нарушений безопасности движения поездов при производстве маневровой и поездной работы Adobe Photoshop. Коррекция изображений
Adobe Photoshop. Коррекция изображений Discovery & IOC Phase Network Architecture
Discovery & IOC Phase Network Architecture Технико-технологические требования по предупреждению газонефтеводопроявлений
Технико-технологические требования по предупреждению газонефтеводопроявлений Артериальная гипертония
Артериальная гипертония Презентация Все профессии важны
Презентация Все профессии важны Имидж педагога в новой образовательной среде
Имидж педагога в новой образовательной среде Кричалки и разминки для детей дошкольного возраста презентация для педагогов и родителей.
Кричалки и разминки для детей дошкольного возраста презентация для педагогов и родителей. Трудный ребенок
Трудный ребенок Технология успешного трудоустройства
Технология успешного трудоустройства Коляда
Коляда С 23 февраля, дорогие наши мальчики
С 23 февраля, дорогие наши мальчики Бедность и богатство
Бедность и богатство День Российской науки – 8 февраля
День Российской науки – 8 февраля Игры для автоматизации звука Ш
Игры для автоматизации звука Ш Опасности, травмы и заболевания, обусловленные неправильными действиями туристов
Опасности, травмы и заболевания, обусловленные неправильными действиями туристов Тайна имени
Тайна имени Оборудование для приготовления и продажи напитков
Оборудование для приготовления и продажи напитков Gravity Falls
Gravity Falls ВКР: Разработка системы автоматизации добычи и промыслового сбора нефти и газа на месторождении
ВКР: Разработка системы автоматизации добычи и промыслового сбора нефти и газа на месторождении Заикание с позиции логопсихокоррекционного подхода
Заикание с позиции логопсихокоррекционного подхода Программы реновации жилья – общая характеристика, возможность тиражирования опыта
Программы реновации жилья – общая характеристика, возможность тиражирования опыта Технология каменных работ
Технология каменных работ