Содержание
- 2. Оксид железа (Оксид железа (II) Гидроксид железа Гидроксид железа (II) Соли железа Соли железа (II) Оксид
- 3. Оксид железа (II) FeO не растворяется в воде и щелочах. По химическим свойствам он близок к
- 4. При взаимодействии оксида железа (II) с сильными окислителями образуются соединения железа (III).
- 5. Оксид железа (II) восстанавливается до железа водородом, углеродом (коксом).
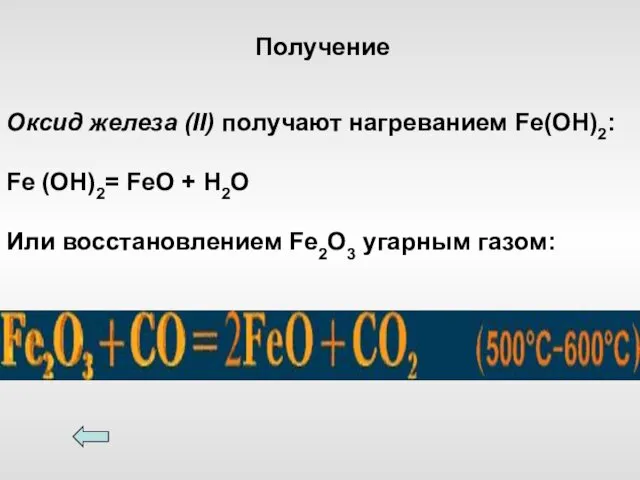
- 6. Оксид железа (II) получают нагреванием Fe(OH)2: Fe (OH)2= FeO + H2O Или восстановлением Fe2O3 угарным газом:
- 7. Гидроксид железа (II) Образуется в виде мелких бледно-зелёных хлопьев при реакции солей железа (II) со щелочами.
- 8. Гидроксид железа (II) проявляет основные свойства, поэтому легко реагирует с кислотами: Легко разлагается при нагревании на
- 9. Гидроксид железа (II) очень легко окисляется кислородом воздуха и другими окислителями: Гидроксид железа (II) очень может
- 10. Соли железа (II) образуются и при растворении железа в кислотах: Fe + H2SO4 = FeSO4 +
- 11. С щелочами соли двухвалентного железа образуют белый осадок гидроксида железа (II): Fe2+ + 2OH- = Fe(ОН)2
- 12. Оксид железа (III)
- 13. Оксид железа (III) получают: нагреванием Fe(OH)3: 2Fe(OH)3 = Fe2O3 + 3H2O разложением солей Fe3+:
- 15. Гидроксид железа (III) Представляет собой бурый аморфный осадок. Его получают действием щелочей на растворы солей трехвалентного
- 16. Fe (ОН) 3 + NaOH = NaFeO2 + 2H2O Гидроксид железа (III), как и соответствующие гидроксиды
- 17. Растворимые соли железа (III) подвергаются гидролизу.
- 18. Качественные реакции Качественными реакциями на ион Fe3+ являются: образование кроваво-красной окраски роданида железа (III) и тёмно-синего
- 20. Скачать презентацию
















 Рациональное питание
Рациональное питание Презентация История жеательной резинки
Презентация История жеательной резинки Правление Ивана IV Грозного (1533-1584)
Правление Ивана IV Грозного (1533-1584) Визитная карточка Д/С № 207
Визитная карточка Д/С № 207 Arduino. Проект: Beyond reason
Arduino. Проект: Beyond reason Спирты
Спирты Родительское собрание
Родительское собрание Большие социальные группы (Тема 4)
Большие социальные группы (Тема 4) Обобщенная структурная схема системы передачи дискретных сообщений (передачи данных)
Обобщенная структурная схема системы передачи дискретных сообщений (передачи данных) Мы делили апельсин. Пальчиковая гимнастика.
Мы делили апельсин. Пальчиковая гимнастика. Опыт проведения православного фестиваля детского художественного творчества Светлая Пасха
Опыт проведения православного фестиваля детского художественного творчества Светлая Пасха Эволюция звезд
Эволюция звезд Дүниежүзі елдерін даму деңгейі бойынша жіктеу
Дүниежүзі елдерін даму деңгейі бойынша жіктеу Правила школьной жизни
Правила школьной жизни Учет денежных средств в иностранной валюте
Учет денежных средств в иностранной валюте Возбуждение уголовного дела
Возбуждение уголовного дела О молитве
О молитве Улицы города Владимир, названные в честь владимирцев - героев Великой Отечественной Войны
Улицы города Владимир, названные в честь владимирцев - героев Великой Отечественной Войны Материал по краеведению Республики Адыгея
Материал по краеведению Республики Адыгея Теория и история потребительской кооперации
Теория и история потребительской кооперации Adding forces
Adding forces проект по теме: Дидактическая игра как средство развития словаря у детей младшего дошкольного возраста
проект по теме: Дидактическая игра как средство развития словаря у детей младшего дошкольного возраста Презентация к занятию Вежливость и доброта
Презентация к занятию Вежливость и доброта Общие положения об обязательствах
Общие положения об обязательствах СССР в годы перестройки
СССР в годы перестройки восприятие мира
восприятие мира Визитная карточка проекта НАШИ ПРЕЗЕНТАЦИИ.
Визитная карточка проекта НАШИ ПРЕЗЕНТАЦИИ. Опасности в Интернете
Опасности в Интернете