Содержание
- 2. Периодический закон Д.И.Менделеева Свойства химических элементов и их соединений находятся в периодической зависимости от заряда их
- 3. Периодическая система химических элементов — это графическое отображение периодического закона. По горизонтали Периодическая система делится на
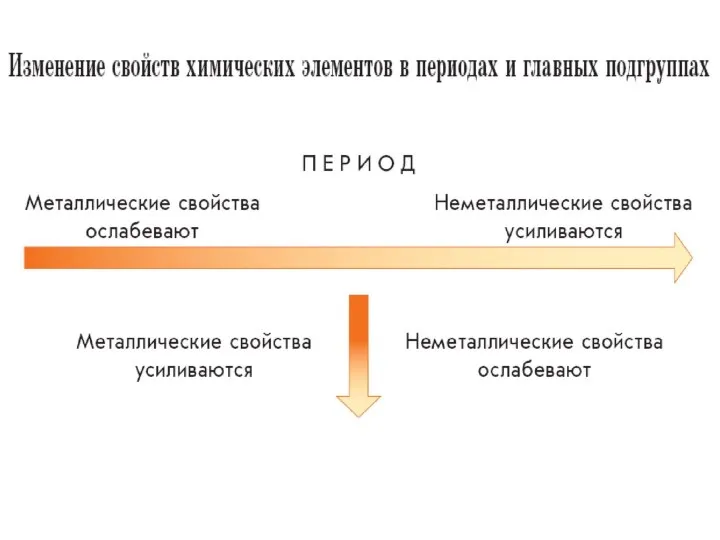
- 4. Периодом называют горизонтальный ряд химических элементов в таблице Менделеева, расположенных в порядке возрастания зарядов их атомных
- 5. Всего в Периодической системе семь периодов. Малым называют период, состоящий только из одного ряда. Большими называют
- 6. Группой называют вертикальный ряд химических элементов в таблице Менделеева, расположенных в порядке возрастания зарядов их атомных
- 7. Главной называют подгруппу, состоящую из элементов и малых, и больших периодов. Побочной называют подгруппу, состоящую только
- 9. Строение атома
- 10. Первой моделью атома, отражающей его сложное строение, была предложенная в 1904 г. модель Дж. Томсона, получившая
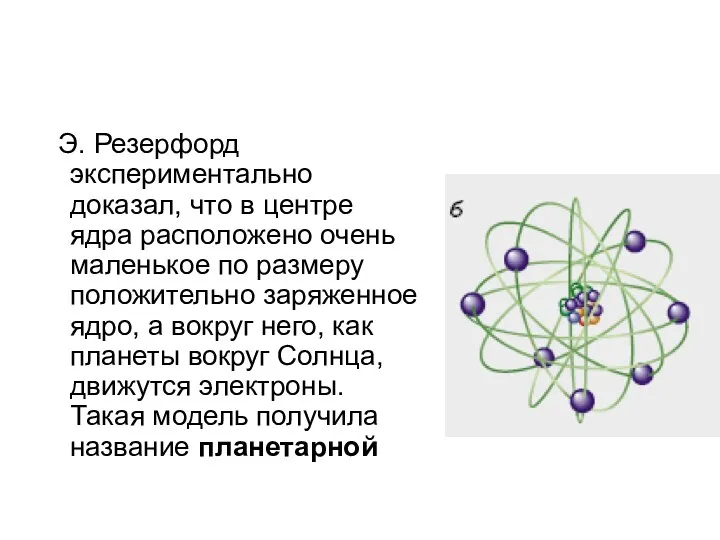
- 11. Э. Резерфорд экспериментально доказал, что в центре ядра расположено очень маленькое по размеру положительно заряженное ядро,
- 12. В 1896 г. французский физик А. Беккерель открыл радиоактивность — самопроизвольный распад атомов некоторых элементов,названных радиоактивными.
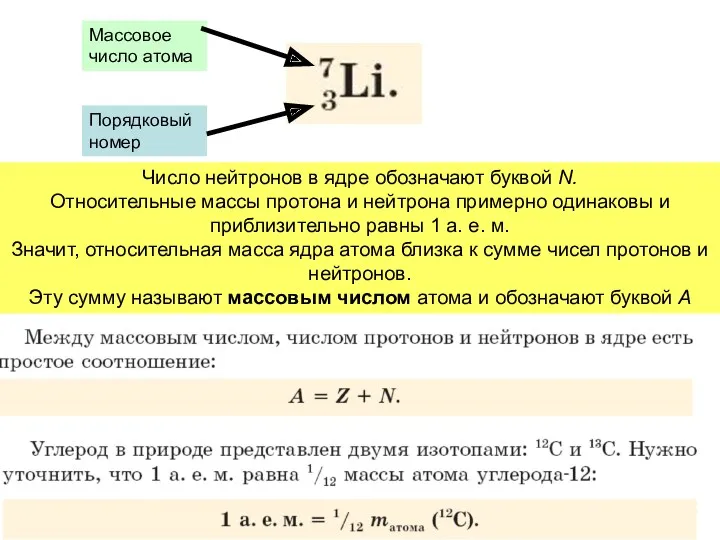
- 14. Число нейтронов в ядре обозначают буквой N. Относительные массы протона и нейтрона примерно одинаковы и приблизительно
- 16. Атомы одного и того же элемента, содержащие в ядрах разное число нейтронов и, следовательно, обладающие различными
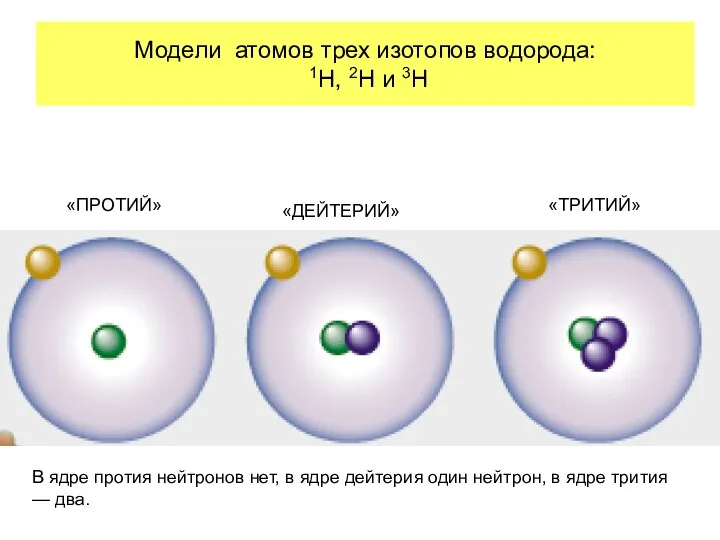
- 17. Модели атомов трех изотопов водорода: 1H, 2H и 3H «ПРОТИЙ» «ДЕЙТЕРИЙ» «ТРИТИЙ» В ядре протия нейтронов
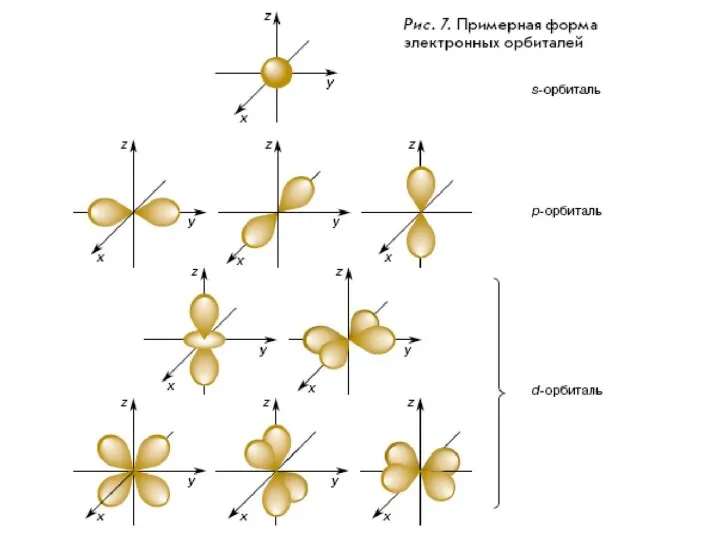
- 18. Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называют орбиталью s-Орбиталь имеет сферическую форму.
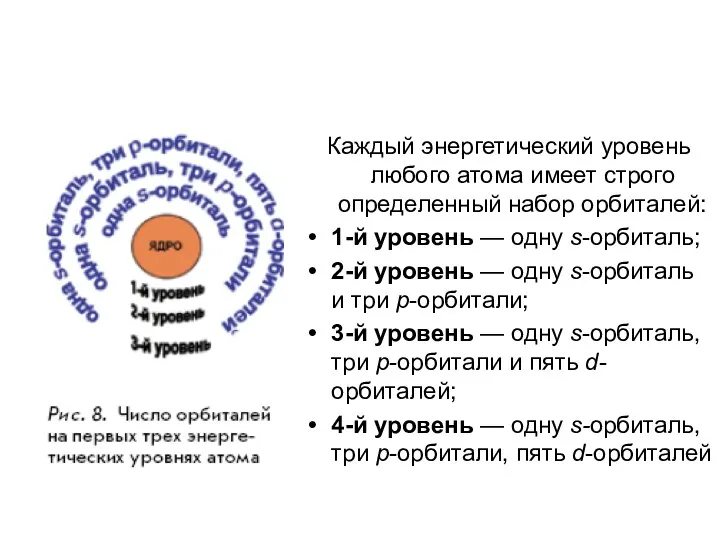
- 20. Каждый энергетический уровень любого атома имеет строго определенный набор орбиталей: 1-й уровень — одну s-орбиталь; 2-й
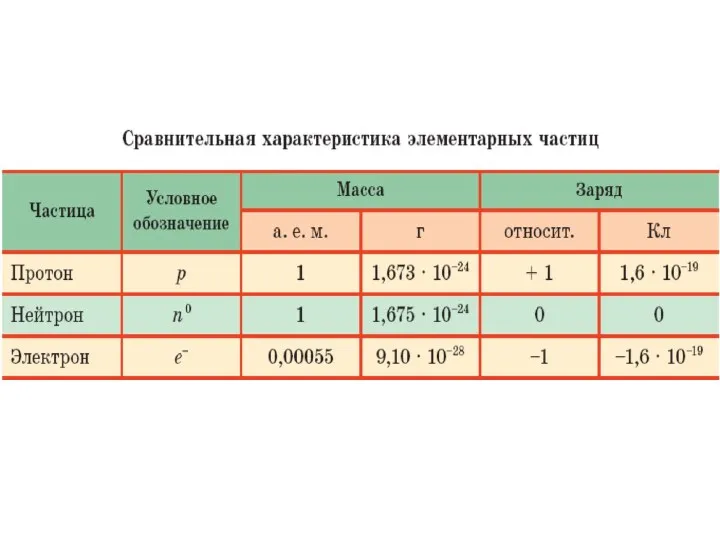
- 21. Атом состоит из ядра и электронной оболочки. Ядро содержит протоны и нейтроны. Вся масса атома сосредоточена
- 22. Электроны в ней располагаются по энергетическим уровням (слоям). Число уровней равно номеру периода, к которому принадлежит
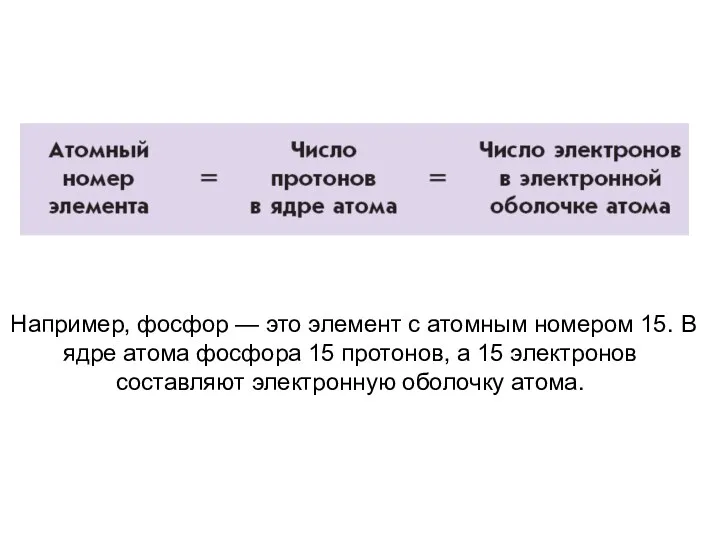
- 23. Например, фосфор — это элемент с атомным номером 15. В ядре атома фосфора 15 протонов, а
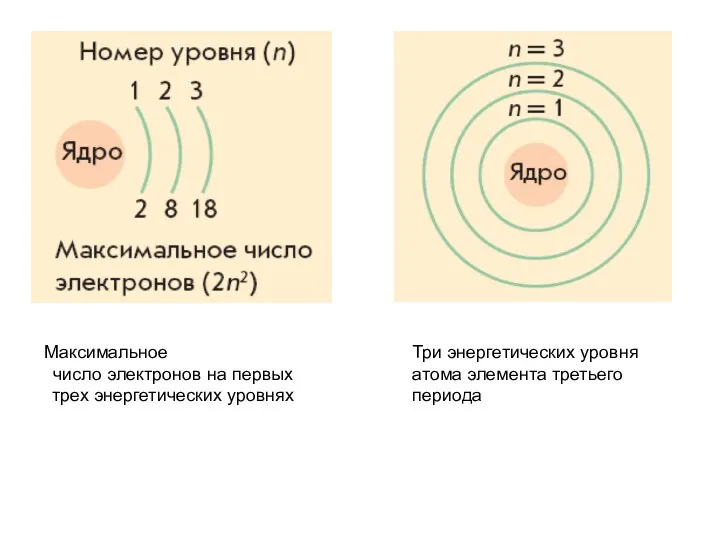
- 24. Три энергетических уровня атома элемента третьего периода Максимальное число электронов на первых трех энергетических уровнях
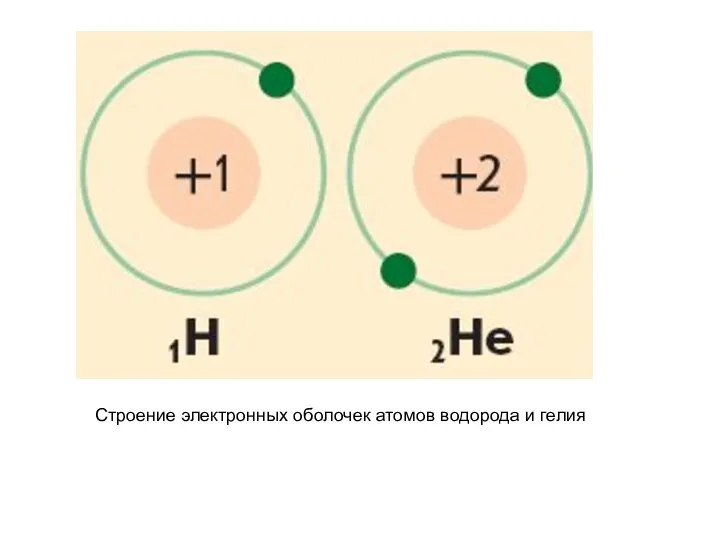
- 25. Строение электронных оболочек атомов водорода и гелия
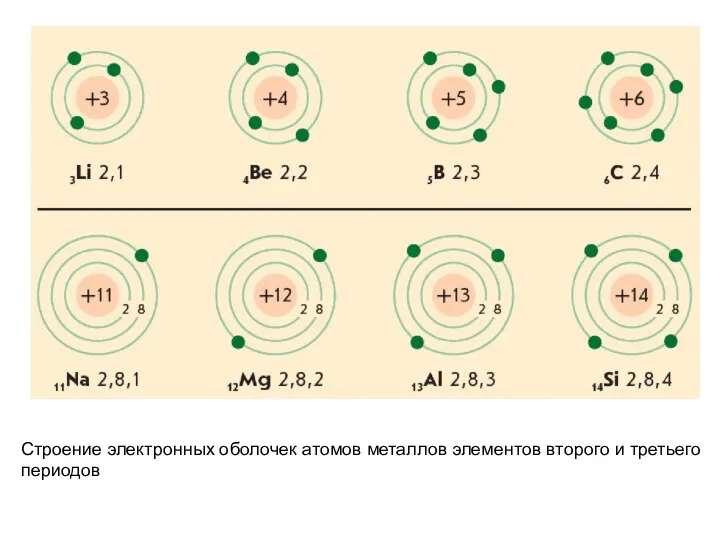
- 26. Строение электронных оболочек атомов металлов элементов второго и третьего периодов
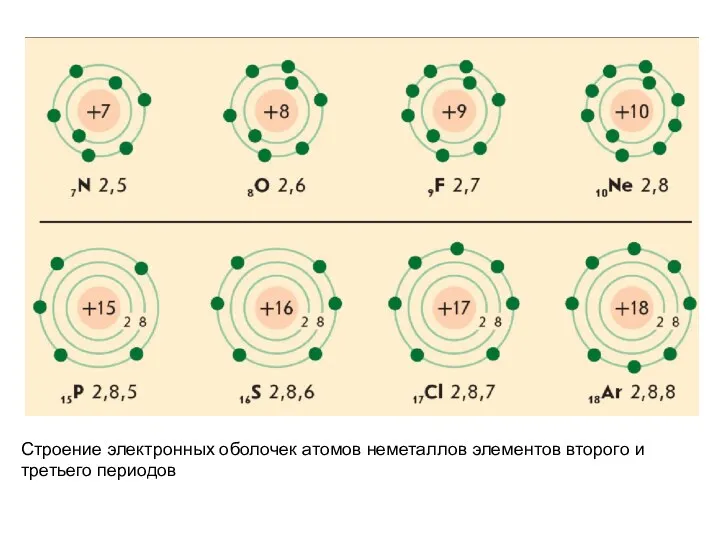
- 27. Строение электронных оболочек атомов неметаллов элементов второго и третьего периодов
- 28. Строение атома и периодический закон 1. Атомный (порядковый) номер химического элемента указывает на положительный заряд атомного
- 30. Скачать презентацию















 Исторический процесс
Исторический процесс Русский язык. Лексика и грамматика
Русский язык. Лексика и грамматика Герой нашего времени. Повесть Тамань
Герой нашего времени. Повесть Тамань Марина Ивановна Цветаева
Марина Ивановна Цветаева викторина От слова к слову
викторина От слова к слову Искусство Средневековья
Искусство Средневековья Грейды по уровням ответственности мануальных тестировщиков
Грейды по уровням ответственности мануальных тестировщиков Мини-проект Золотая нить времени
Мини-проект Золотая нить времени 23 февраля - День защитника Отечества
23 февраля - День защитника Отечества Оценка технических свойств древесины и материалов
Оценка технических свойств древесины и материалов Деление на однозначное число.2
Деление на однозначное число.2 Training course introduction to psr system
Training course introduction to psr system Зима. Мое любимое время года
Зима. Мое любимое время года Человек: строение, система органов
Человек: строение, система органов Лекция 1. Общая характеристика психологии как науки
Лекция 1. Общая характеристика психологии как науки Упрощенная система налогообложения
Упрощенная система налогообложения Гуляй, Масленица!
Гуляй, Масленица! Структура педагогического проекта
Структура педагогического проекта Презентация Деятельностный подход к формированию экологической культуры младших школьников
Презентация Деятельностный подход к формированию экологической культуры младших школьников Регистрация религиозных объединений
Регистрация религиозных объединений отбасым алтын ұям ІІ бөлім
отбасым алтын ұям ІІ бөлім Выбираем профессию
Выбираем профессию 1 сентября Волшебная Страна Знаний
1 сентября Волшебная Страна Знаний духовно - нравственное воспитание
духовно - нравственное воспитание Слайды
Слайды Проект рабочей программы (образовательные области: Познание, Речевое развитие) подготовительная группа
Проект рабочей программы (образовательные области: Познание, Речевое развитие) подготовительная группа Тұқы балықтары. Қазақстанда балықтардың ресурстары
Тұқы балықтары. Қазақстанда балықтардың ресурстары Синдром дефицита внимания с гиперактивностью
Синдром дефицита внимания с гиперактивностью