Содержание
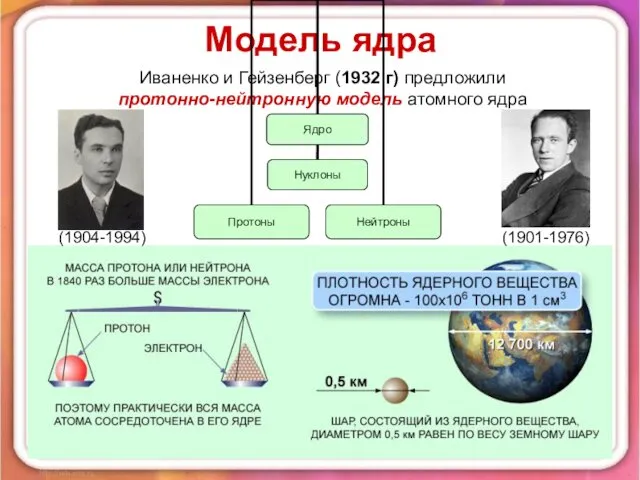
- 2. Модель ядра Иваненко и Гейзенберг (1932 г) предложили протонно-нейтронную модель атомного ядра (1904-1994) (1901-1976)
- 3. Состав атомного ядра Общее число нуклонов в данном ядре называется массовым числом, обозначается Число протонов в
- 4. Протонно-нейтронная модель ядра Ядро + протон нейтрон Z – число протонов в ядре N – число
- 5. Изотопы У одного и того же химического элемента встречаются атомы с различными по массе ядрами. Ядра
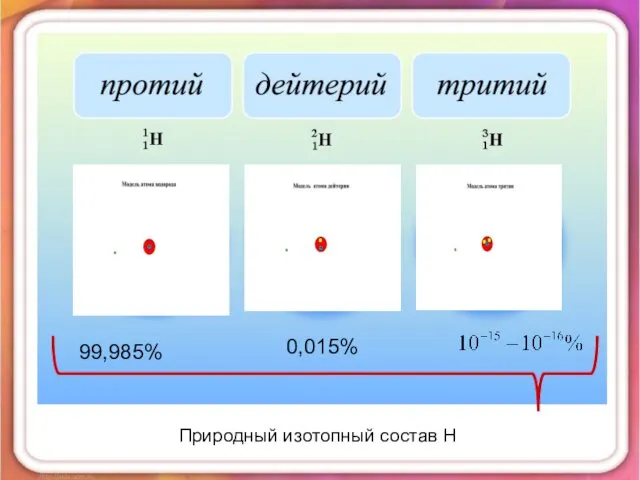
- 6. 99,985% 0,015% Природный изотопный состав Н
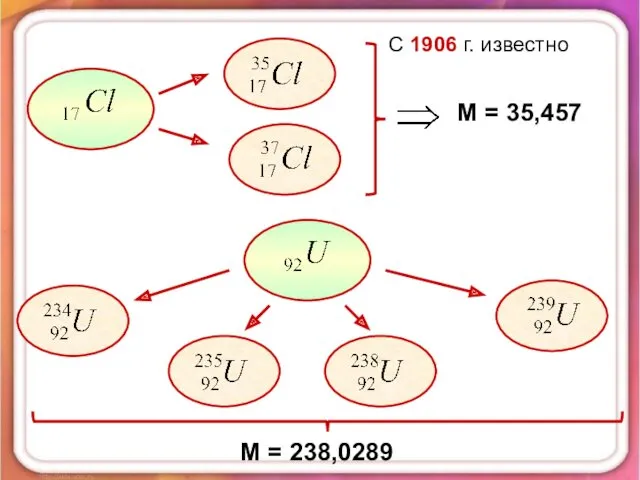
- 7. С 1906 г. известно М = 35,457 М = 238,0289
- 11. Скачать презентацию





 Як святкують новий рік у різних країнах світу
Як святкують новий рік у різних країнах світу Общие черты и особенности экономического развития Германии и США в конце 19-ого-начале 20-ого века
Общие черты и особенности экономического развития Германии и США в конце 19-ого-начале 20-ого века интеллектуальный марафон
интеллектуальный марафон Организация практики
Организация практики Осциллографы
Осциллографы Материк Евразия. Обобщение. 7 класс
Материк Евразия. Обобщение. 7 класс Древний Египет
Древний Египет Методы защиты от коррозии
Методы защиты от коррозии Вазоконстрикторы и антигипотензивные средства
Вазоконстрикторы и антигипотензивные средства Химико-технологическая система, ее состав и структура
Химико-технологическая система, ее состав и структура Экология. Общая экология. Экологическое право. Экология популяций и экосистем
Экология. Общая экология. Экологическое право. Экология популяций и экосистем Хочу всё знать. Интеллектуальная игра для дошкольников
Хочу всё знать. Интеллектуальная игра для дошкольников Презентация к методическому семинару
Презентация к методическому семинару Правонарушение. Юридическая ответственность и её виды
Правонарушение. Юридическая ответственность и её виды Сучасні програмні продукти моделювання та симуляції електронних схем
Сучасні програмні продукти моделювання та симуляції електронних схем Базовые конкурентные стратегии по Майклу Портеру
Базовые конкурентные стратегии по Майклу Портеру Разработка открытого урока, данный в ходе всероссийского конкурса- Учитель года-2014 по теме Реки.
Разработка открытого урока, данный в ходе всероссийского конкурса- Учитель года-2014 по теме Реки. Как не стать жертвой наркомании
Как не стать жертвой наркомании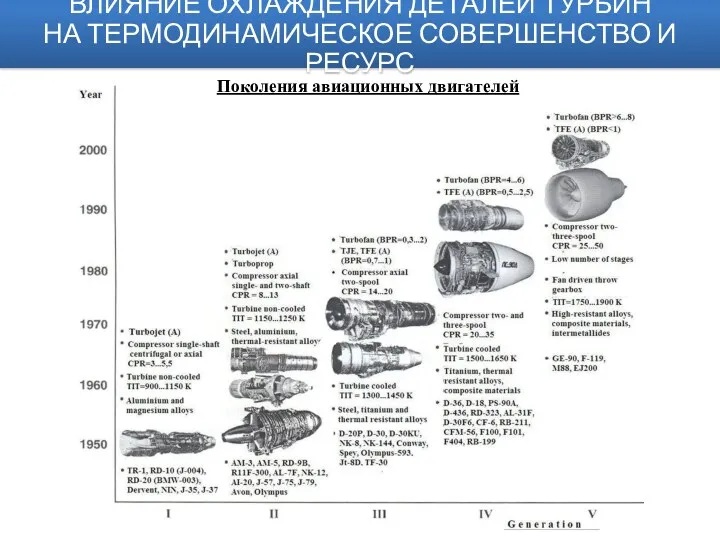 Авиационные двигатели. Влияние охлаждения деталей турбин на термодинамическое совершенство и ресурс прочности лопаток
Авиационные двигатели. Влияние охлаждения деталей турбин на термодинамическое совершенство и ресурс прочности лопаток Мембранные покрытия
Мембранные покрытия Коррекция речевых нарушений у старших дошкольников в условиях логопедического пункта в ДОУ
Коррекция речевых нарушений у старших дошкольников в условиях логопедического пункта в ДОУ Аппаратная часть компьютерной системы
Аппаратная часть компьютерной системы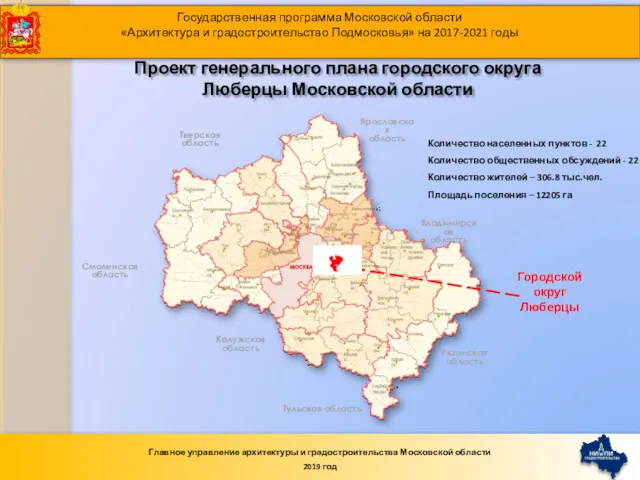 Проект генерального плана городского округа Люберцы Московской области
Проект генерального плана городского округа Люберцы Московской области Классный час Откуда берутся грязнули
Классный час Откуда берутся грязнули Винсент Ван Гог 1853-1890 (37 лет)
Винсент Ван Гог 1853-1890 (37 лет) Зимний подарок Презентация
Зимний подарок Презентация Презентация Живи, память, живи!
Презентация Живи, память, живи! Презентация Курить - здоровью вредить.
Презентация Курить - здоровью вредить.