I. Электронная оболочка – это совокупность электронов, двигающихся вокруг ядра атома.
Тема:
Строение электронных оболочек атомов.
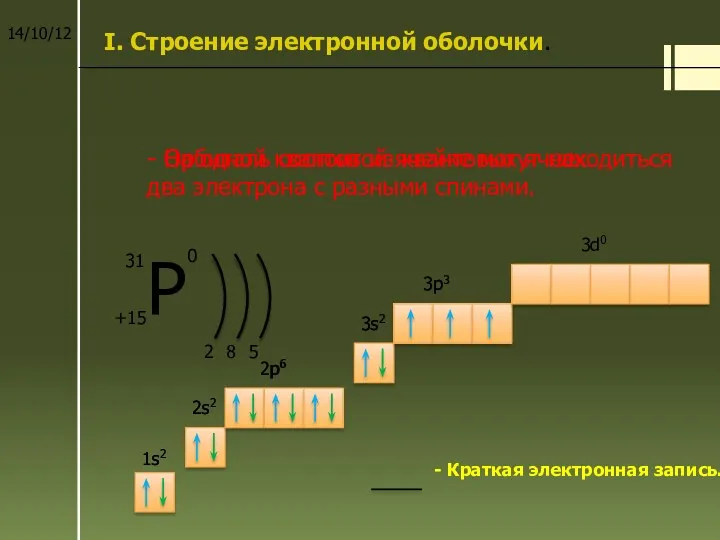
Электроны в электронной оболочке располагаются на энергетических уровнях.
n – главное квантовое число – определяет число энергетических уровней .
Номер периода совпадает с числом энергетических уровней элемента.
Период
3
Группа
V
3
Число электронов (N) на уровне рассчитывается по формуле.
N = 2n2
n = 1, N = 2 . 12 = 2
2
n = 2, N = 2 . 22 = 8
8
Номер группы совпадает с числом электронов на последнем энергетическом уровне.
5
Общее число электронов
е =
15
Проверка
15






 Абстрактно-логическое мышление
Абстрактно-логическое мышление Коррекционно-развивающие занятия с детьми с ЗПР по ОЗОМ
Коррекционно-развивающие занятия с детьми с ЗПР по ОЗОМ Таня, я тебя люблю больше жизни
Таня, я тебя люблю больше жизни Подарок своими руками. Игольница Ягодка.
Подарок своими руками. Игольница Ягодка. Похвальное слово о казаках. Презентация.
Похвальное слово о казаках. Презентация. Отчёт. Производственная практика Эксплуатация нефтегазопромыслового оборудования. Тема задания: Обсадные колонны
Отчёт. Производственная практика Эксплуатация нефтегазопромыслового оборудования. Тема задания: Обсадные колонны Презентация по теме: Внутренние воды Южной Америки.
Презентация по теме: Внутренние воды Южной Америки. презентация Развитие познавательных способностей детей через исследовательскую деятельность
презентация Развитие познавательных способностей детей через исследовательскую деятельность Институт физической культуры, спорта и туризма
Институт физической культуры, спорта и туризма Внешняя политика России в ХVII веке. Присоединение Сибири и Предуралья
Внешняя политика России в ХVII веке. Присоединение Сибири и Предуралья Лиття в оболонкові форми та за виплавлювальними моделями
Лиття в оболонкові форми та за виплавлювальними моделями Театрализованная деятельность, как средство формирования связной речи у дошкольников презентация
Театрализованная деятельность, как средство формирования связной речи у дошкольников презентация Виды терроризма
Виды терроризма Кирило - Мефодіївське братство. Історія України
Кирило - Мефодіївське братство. Історія України Экономическая культура
Экономическая культура Тянь-Шань тауында кездесетін сүтқоректілер
Тянь-Шань тауында кездесетін сүтқоректілер Утренняя гимнастика
Утренняя гимнастика Повреждения позвоночника
Повреждения позвоночника Курская дуга
Курская дуга Общая структурная схема ПК (лекция 8)
Общая структурная схема ПК (лекция 8) Презентация Мой город Зеленокумск
Презентация Мой город Зеленокумск Активные и пассивные системы в архитектурном проектировании энергоэффективных зданий. Экономическая эффективность систем
Активные и пассивные системы в архитектурном проектировании энергоэффективных зданий. Экономическая эффективность систем Основные тригонометрические тождества
Основные тригонометрические тождества Проектно-исследовательская деятельность в начальной школе на уроках и во внеурочное время
Проектно-исследовательская деятельность в начальной школе на уроках и во внеурочное время Исполнение токовых цифровых защит
Исполнение токовых цифровых защит Детский травматизм
Детский травматизм Имена существительные собственные и нарицательные
Имена существительные собственные и нарицательные Великие химики России.
Великие химики России.