Содержание
- 2. Белки полимерные молекулы, мономеры - аминокислоты. В составе белков в организме человека встречают 20 α-аминокислот.
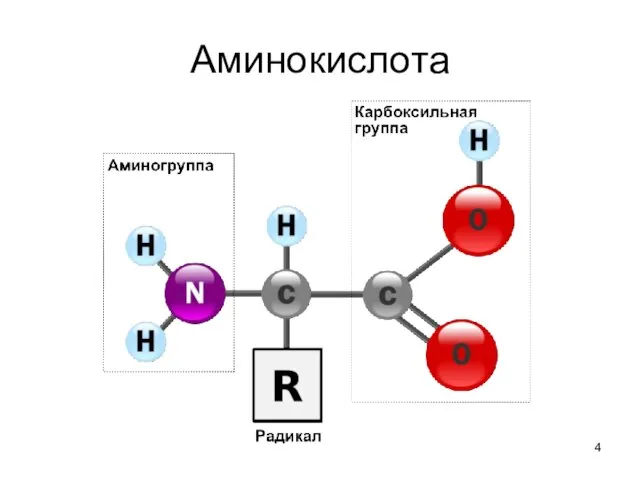
- 3. Общие структурные особенности аминокислот, входящих в состав белков наличие амино- и карбоксильной групп, соединённых с одним
- 4. Аминокислота
- 5. Классификация аминокислот По радикалу Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан Полярные незаряженные
- 6. Классификация аминокислот По функциональным группам (радикалам) Ароматические: фенилаланин, тирозин, триптофан Гетероциклические: гистидин, пролин Серосодержащие: цистеин, метионин
- 7. Классификация аминокислот Незаменимые валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин. Заменимые глицин, аланин,
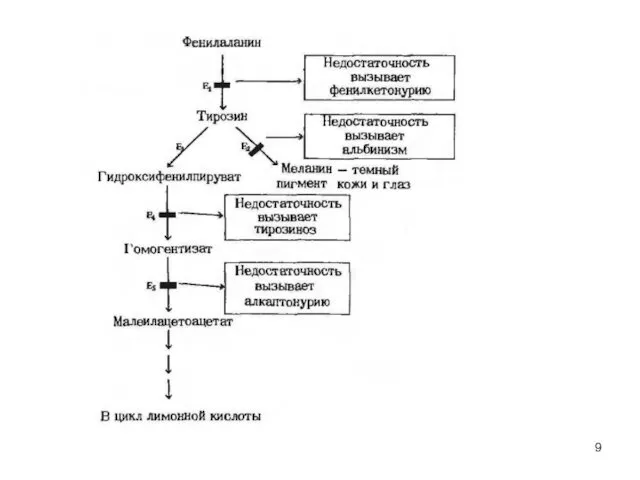
- 8. Схема 1 Особенности обмена аминокислот. Обмен фенилаланина
- 10. Пептидная связь α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется
- 12. СТРУКТУРА БЕЛКА Пептидные цепи содержат а/к остатки, соединены пептидными связями. (прочные, разрыв - фермент) Белок имее
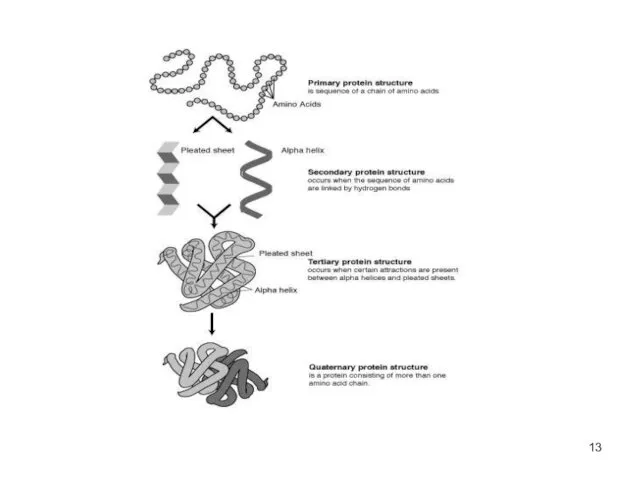
- 14. Первичная структура белка линейная последовательность а/к в полипептидной цепи первичная структура каждого белка закодирована в одном
- 15. Вторичная структура белка
- 16. Вторичная структура белка регулярные структуры двух типов: α-спираль и β-структура.
- 17. α-Спираль пептидный остов закручивается в виде спирали водородных связи образуются между атомами кислорода карбонильных групп и
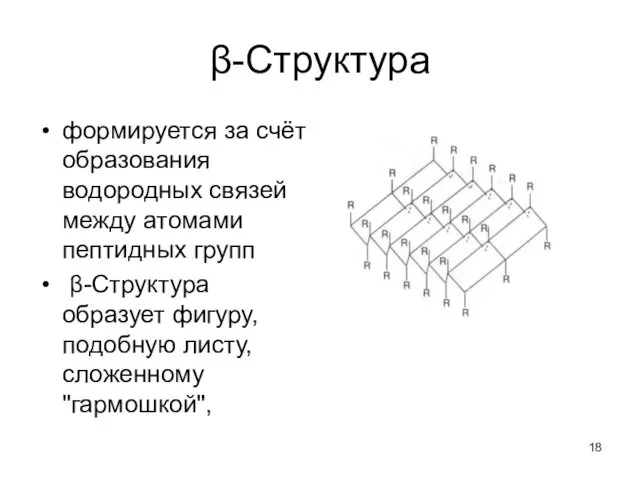
- 18. β-Структура формируется за счёт образования водородных связей между атомами пептидных групп β-Структура образует фигуру, подобную листу,
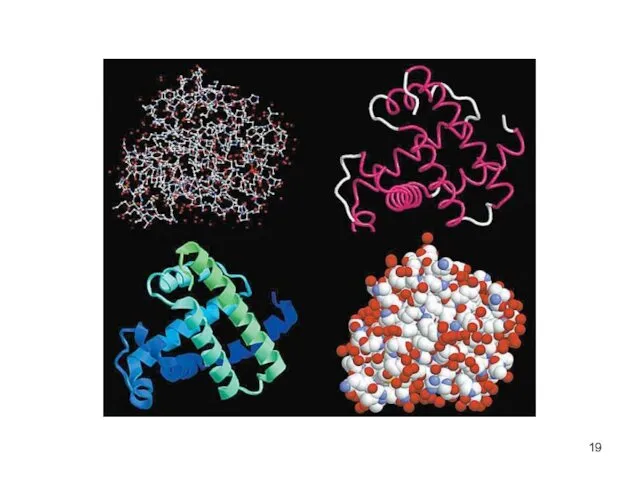
- 20. Третичная структура белков трёхмерная пространственная структура образуетсяза счёт взаимодействий между радикалами аминокислот, стоящих на значительном расстоянии
- 21. Четвертичная структура Несколько глобул Одна глобула + кофактор и/или кофермент
- 22. КОФАКТОРЫ И КОФЕРМЕНТЫ Большинство ферментов для активности нуждается в: низкомолекулярных органических соединениях небелковой природы (коферментах) и/или
- 23. Функции белков в организме Каталитическая функция Структурная функция Защитная функция Регуляторная функция Сигнальная функция Транспортная функция
- 24. Каталитическая функция Ферменты (энзимы) – белки - увеличивают скорость протекания химической реакции, при этом не расходуются
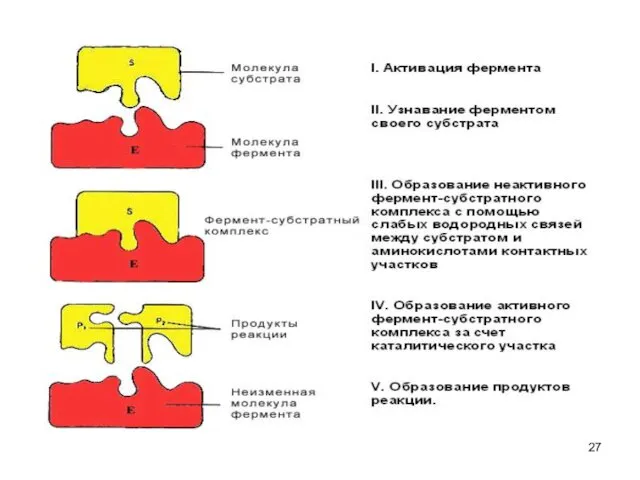
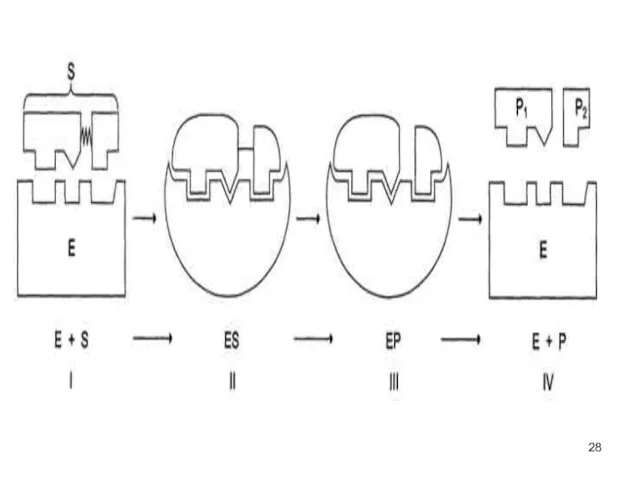
- 25. Фермент-субстратные реакции В участке связывания субстрат связывается с ферментом - фермент-субстратный комплекс. В каталитическом участке субстрат
- 26. Катализ Схематично процесс катализа можно представить следующим уравнением: Е + S ↔ ES ↔ ЕР ↔
- 30. Специфичность наиболее важное свойство ферментов. субстратная сп.- способность фермента взаимодействовать лишь с одним или несколькими определёнными
- 31. Специфичность Выделяют абсолютную субстратную специфичность (катализ 1 субстрата) - аргиназа; групповую субстратную специфичность однотипные реакции с
- 32. Каталитическая специфичность Фермент превращает субстрат по одному из возможных путей его превращения Зависит от строения каталитического
- 33. Номенклатура и классификация ферментов В настоящее время известно более 2400 ферментов. Каждый фермент, как правило, имеет
- 34. Вещество, имеющее это окончание, принимают за фермент. Ферменты, действующие на крахмал (amylum), сахарозу, мочевину (urea), пептиды
- 35. ферменты, катализирующие процессы гидролиза называют гидролазами, процессы окисления - оксидазами, перенос групп - трнсферазами и т.д.
- 36. КОФАКТОРЫ И КОФЕРМЕНТЫ Большинство ферментов для активности нуждается в: низкомолекулярных органических соединениях небелковой природы (коферментах) и/или
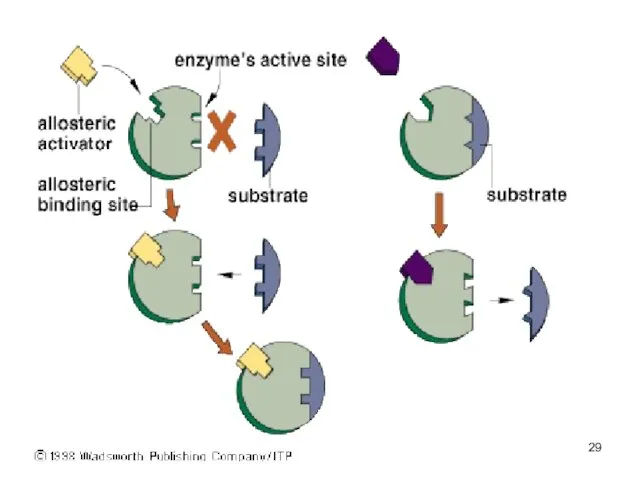
- 37. Регуляция работы ферментов Активность ферментов зависит от количества: молекул субстрата продукта наличия кофакторов и коферментов. Каскад
- 38. Среди множества ферментов практически каждого метаболического пути различают ключевые, или регуляторные, ферменты, активность которых может изменяться
- 40. Скачать презентацию





























 Профессия социолог
Профессия социолог Компания ЭнергоТехСервис
Компания ЭнергоТехСервис Презентация к уроку в 7 классе по ОЗОЖ.
Презентация к уроку в 7 классе по ОЗОЖ. Ионизирующие излучения
Ионизирующие излучения Composition restaurant premises
Composition restaurant premises Frequently asked questions about Frontend Developer position at AnyforSoft
Frequently asked questions about Frontend Developer position at AnyforSoft Климактерический синдром
Климактерический синдром Анатомия центральной нервной системы. Средний мозг
Анатомия центральной нервной системы. Средний мозг Монолитное строительство
Монолитное строительство Бумажная аппликация
Бумажная аппликация Алексей Петрович Маресьев (1916-2001)
Алексей Петрович Маресьев (1916-2001) Будда реальний і Будда із легенд
Будда реальний і Будда із легенд Электронная презентация Из глубины веков
Электронная презентация Из глубины веков Организация речевого уголка в ДОУ
Организация речевого уголка в ДОУ Санитарные требования к транспортировке и хранению пищевых продуктов
Санитарные требования к транспортировке и хранению пищевых продуктов Управление транспортными средствами лицами в состоянии опьянения
Управление транспортными средствами лицами в состоянии опьянения Загрязнения Мирового океана
Загрязнения Мирового океана Презентация к классному часу Время сеять добро. Крещение
Презентация к классному часу Время сеять добро. Крещение Трудности формирования навыков чтения у школьников
Трудности формирования навыков чтения у школьников Второй закон термодинамики и работоспособность термодинамических систем. (Лекция 6)
Второй закон термодинамики и работоспособность термодинамических систем. (Лекция 6) Исход
Исход Жестокое обращение с детьми
Жестокое обращение с детьми 2015 - Advertising in shop
2015 - Advertising in shop Автомобильная промышленность Японии
Автомобильная промышленность Японии Презентация День народного единства
Презентация День народного единства Дикие животные
Дикие животные Физиология пищеварения
Физиология пищеварения Усиление и замена несущих конструкций при реконструкции производственных зданий. (Лекция 4)
Усиление и замена несущих конструкций при реконструкции производственных зданий. (Лекция 4)