Содержание
- 2. Второй закон термодинамики Формулировка Р. Клаузиуса: "Теплота не может сама собой переходить от холодного тела к
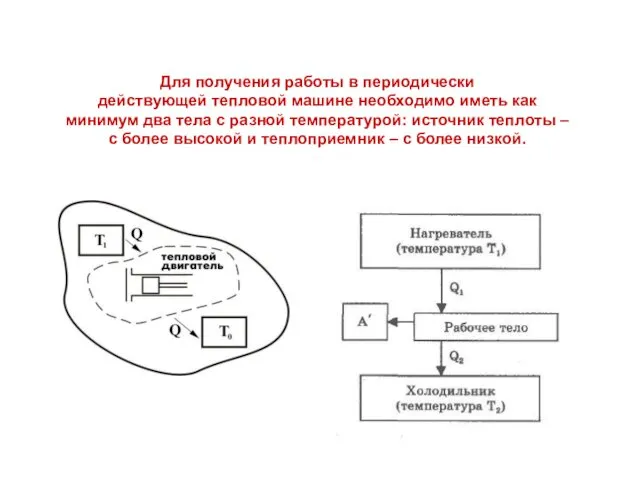
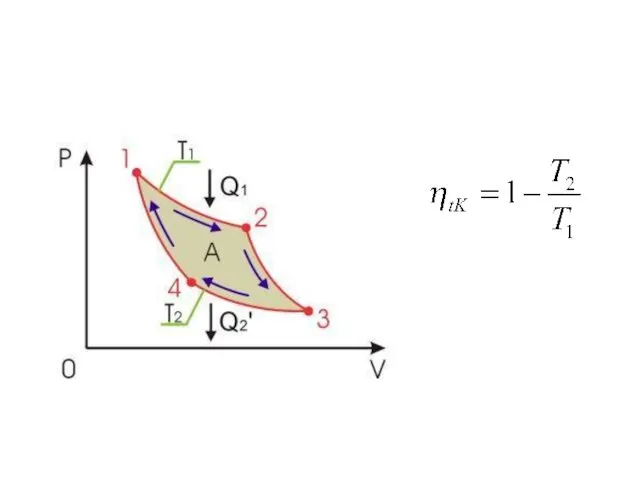
- 3. Для получения работы в периодически действующей тепловой машине необходимо иметь как минимум два тела с разной
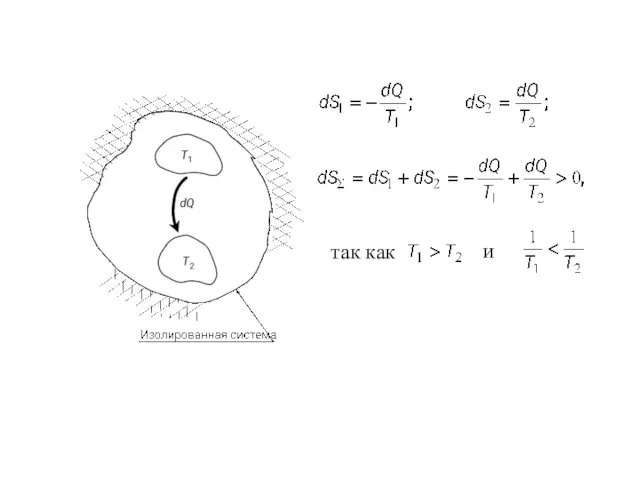
- 5. так как и
- 6. Математическое выражение второго закона При протекании необратимых процессов в изолированной системе При протекании обратимых процессов в
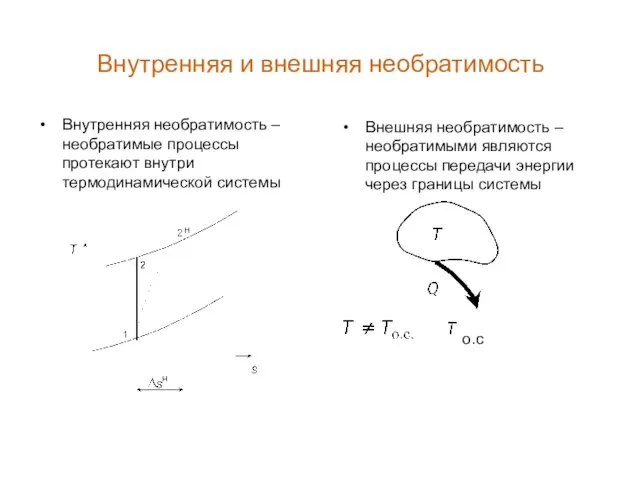
- 7. Внутренняя и внешняя необратимость Внутренняя необратимость – необратимые процессы протекают внутри термодинамической системы Внешняя необратимость –
- 8. Влияние необратимости на запас работоспособности термодинамических систем До теплообмена После частичного теплообмена Рабочее тело Рабочее тело
- 9. Максимальная работа. Эксергия
- 10. Получение работы в изолированной системе В изолированной термодинамической системе возможно получение механической работы при наличии в
- 11. Получение работы в изолированной системе Система может прийти в состояние равновесия и без совершения полезной работы,
- 12. Для оценки максимально возможного количества полезной работы, которое может быть получено в таких системах, в 1955
- 13. Понятие эксергии Эксергия – это максимальная работа, которую может совершить термодинамическая система в процессе обратимого перехода
- 14. Понятие эксергии Эксергии будет соответствовать работа на штоке поршня при обратимом переходе тела из первоначального состояния
- 15. Эксергия потока вещества
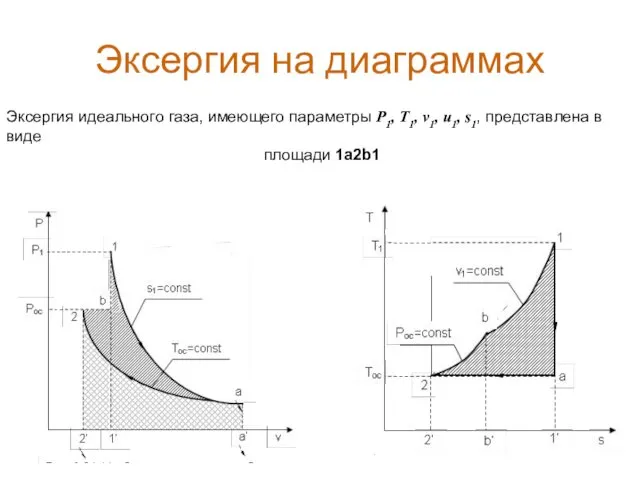
- 16. Эксергия на диаграммах Эксергия идеального газа, имеющего параметры P1, T1, v1, u1, s1, представлена в виде
- 18. Скачать презентацию










 Презентация Времена года.Зима к НОД по лексической теме Зима.
Презентация Времена года.Зима к НОД по лексической теме Зима. Характеристические уравнения реакторов
Характеристические уравнения реакторов Профессиональная пригодность
Профессиональная пригодность Презентация Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов 9 класс
Презентация Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов 9 класс Нанотехнології наноматеріалу
Нанотехнології наноматеріалу Химическая промышленность
Химическая промышленность Францішак Багушэвіч (9-11 класы)
Францішак Багушэвіч (9-11 класы) С праздником весны!
С праздником весны! Пам'ять. Мислення
Пам'ять. Мислення Любовная лирика А.С. Пушкина. Вдохновенные строки
Любовная лирика А.С. Пушкина. Вдохновенные строки Из опыта работы воспитателя МДОУ детского сада комбинированного вида №100 Дюймовочка
Из опыта работы воспитателя МДОУ детского сада комбинированного вида №100 Дюймовочка Страны Востока в XVI – XVIII веках
Страны Востока в XVI – XVIII веках Перемещение тела при равноускоренном движении
Перемещение тела при равноускоренном движении Творческо - познавательный проект Времена года. Осень.
Творческо - познавательный проект Времена года. Осень. Презентация
Презентация Федеральный закон Об информации, информационных технологиях и о защите информации
Федеральный закон Об информации, информационных технологиях и о защите информации Публицистический стиль. Функции языка, реализуемые в публицистических текстах. Лексика и фразеология
Публицистический стиль. Функции языка, реализуемые в публицистических текстах. Лексика и фразеология Ты сам мастер декоративно-прикладного искусства
Ты сам мастер декоративно-прикладного искусства Классный час О вреде курения
Классный час О вреде курения Мезенская роспись
Мезенская роспись Налог на прибыль организаций
Налог на прибыль организаций Инвестиционный проект как объект финансирования
Инвестиционный проект как объект финансирования Царство животные. Трехслойные животные. Черви
Царство животные. Трехслойные животные. Черви Проблемы строительства и реконструкции в геотехнических условиях города Тюмени
Проблемы строительства и реконструкции в геотехнических условиях города Тюмени Шаблон для защиты дипломного проекта. Рязанский колледж электроники
Шаблон для защиты дипломного проекта. Рязанский колледж электроники Развитие туризма в Чукотском автономном округе
Развитие туризма в Чукотском автономном округе Урок 20 Заполнение основной надписи и печать в КОМПАС
Урок 20 Заполнение основной надписи и печать в КОМПАС Презентация..Роль комнатных растений в жизни человека
Презентация..Роль комнатных растений в жизни человека