Содержание
- 2. Тема 3. Строение вещества Преподаватель Вера Дмитриевна Колобова Киров, 2020 г ККМИ им. И. В. Казенина
- 3. Переписать всё (если иное не указано) с каждого слайда и осмыслить
- 4. 1. Природа химической связи Химическую связь обусловливает электростатическое взаимодействие между отрицательно заряженными электронами и положительно заряженными
- 5. Почему атомы объединяются в молекулы? Молекулярное состояние наиболее устойчивое, чем атомное. То есть оно, во-первых, энергетически
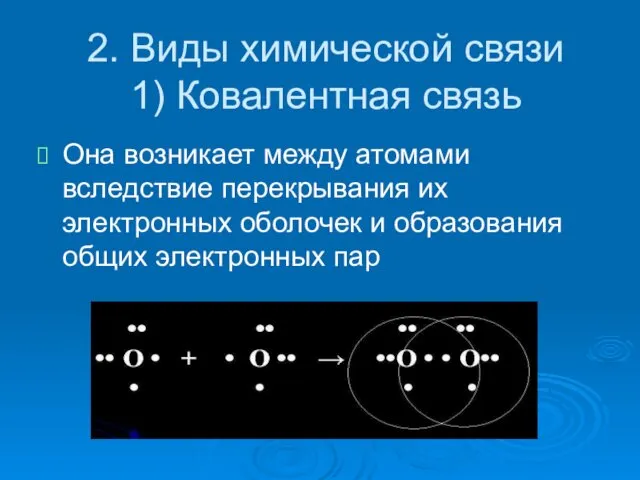
- 6. 2. Виды химической связи 1) Ковалентная связь Она возникает между атомами вследствие перекрывания их электронных оболочек
- 7. Ковалентная неполярная связь Такую связь образуют атомы одного и того же химического элемента - неметалла (например,
- 8. ПРОЧИТАТЬ И ПОНЯТЬ Механизм образования ковалентной неполярной связи: Каждый атом неметалла отдает в общее пользование другому
- 9. Ковалентная полярная связь Такую связь образуют атомы разных неметаллов, отличающихся по значения электроотрицательности (например, HCl, H2O)
- 10. ПРОЧИТАТЬ И ПОНЯТЬ Механизм образования ковалентной полярной связи: Каждый атом неметалла отдает в общее пользование другому
- 11. Вещества с ковалентной связью могут быть твёрдыми, жидкими и газообразными с атомной или молекулярной решётками и
- 12. Эта химическая связь образуется между ионами по электростатическому механизму Ионные соединения образуются атомами элементов, резко отличающихся
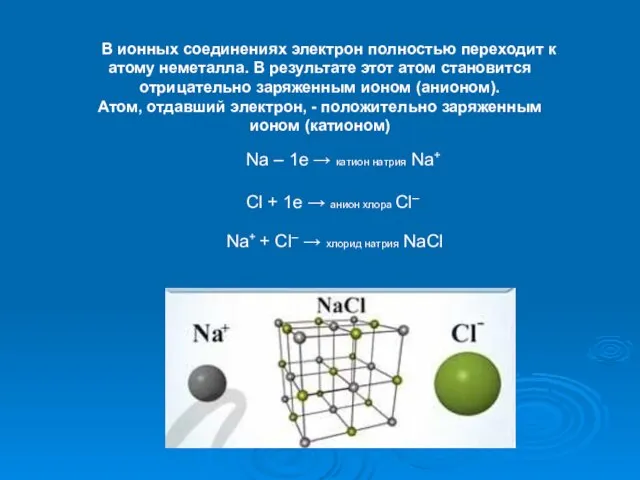
- 13. В ионных соединениях электрон полностью переходит к атому неметалла. В результате этот атом становится отрицательно заряженным
- 14. Соединения с ионным типом связи – это твёрдые кристаллические вещества с ионной кристаллической решёткой и они
- 15. Металли́ческая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт перекрытия (обобществления) их
- 16. Механизм металлической связи Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов
- 17. ПРОЧИТАТЬ И ПОНЯТЬ Металлическая связь характерна для чистых металлов и для смесей различных металлов — сплавов
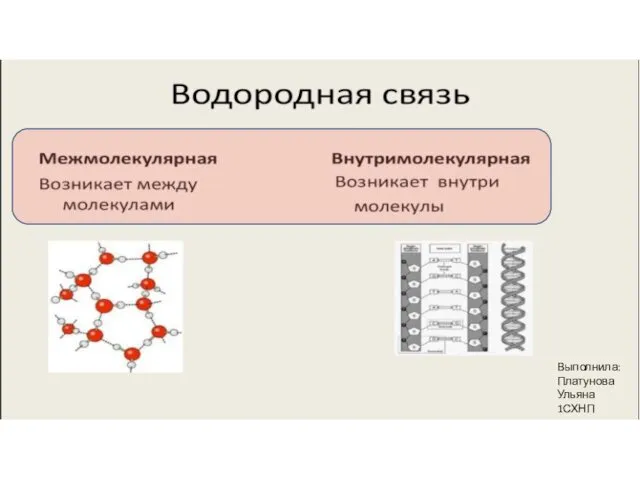
- 18. 2. Виды химической связи 4) Водородная связь Далее переписать то, что выделено рамкой:
- 19. Выполнила: Платунова Ульяна 1СХНП
- 20. МЕХАНИЗМ ОБРАЗОВАНИЯ ВОДОРОДНОЙ СВЯЗИ Образование водородной связи происходит частично по электростатическому, частично по донорно-акцепторному механизму. Донором
- 21. Выполнила: Платунова Ульяна 1СХНП
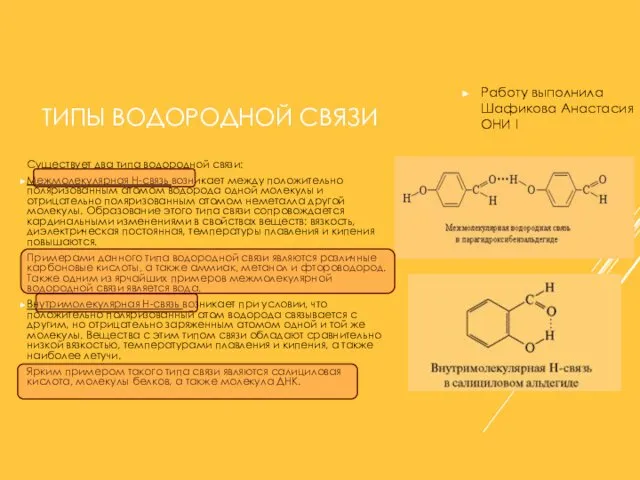
- 22. ТИПЫ ВОДОРОДНОЙ СВЯЗИ Существует два типа водородной связи: Межмолекулярная Н-связь возникает между положительно поляризованным атомом водорода
- 23. ПРИМЕРЫ СОЕДИНЕНИЙ С ВОДОРОДНОЙ СВЯЗЬЮ Помимо уже известного нам яркого представителя веществ с водородной связью –
- 24. 3. ВЗАИМОСВЯЗЬ ТИПА ХИМИЧЕСКОЙ СВЯЗИ С ВИДОМ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ РАБОТУ ВЫПОЛНИЛИ ВЕРЕТЕННИКОВА ДАРЬЯ И ГИЛЬМУТДИНОВА АДЕЛИНА
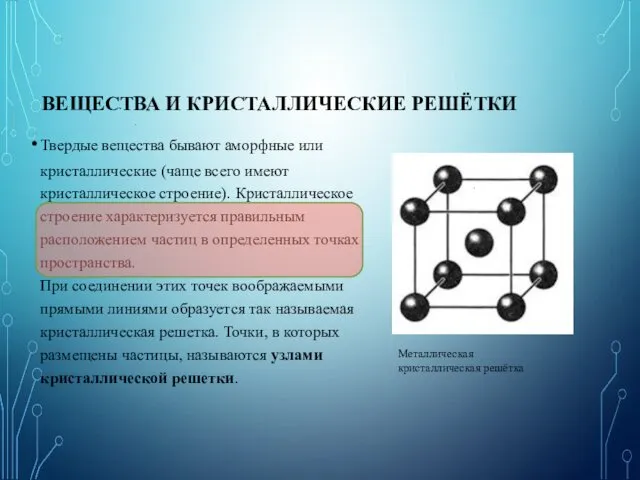
- 25. ВЕЩЕСТВА И КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение). Кристаллическое
- 26. ИОННАЯ РЕШЕТКА Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения
- 27. СВОЙСТВА ИОННЫХ КРИСТАЛЛОВ Твёрдые, но хрупкие; Отличаются высокими температурами плавления; Нелетучи, не имеют запаха; Расплавы ионных
- 28. МЕТАЛЛИЧЕСКАЯ РЕШЕТКА Характерна для веществ с металлической связью. Реализуется в простых веществах — металлах и их
- 29. СВОЙСТВА ВЕЩЕСТВ С МЕТАЛЛИЧЕСКОЙ РЕШЕТКОЙ: тепло- и электропроводность; обладают металлическим блеском; высокие температуры плавления.
- 30. АТОМНАЯ РЕШЕТКА Самая прочная кристаллическая решетка. В узлах решетки — атомы, связанные ковалентными связями. Химическая связь
- 31. СВОЙСТВА ВЕЩЕСТВ С АТОМНОЙ РЕШЕТКОЙ: Высокая твердость; Высокие температуры плавления; Нерастворимость; Нелетучесть; Отсутствие запаха.
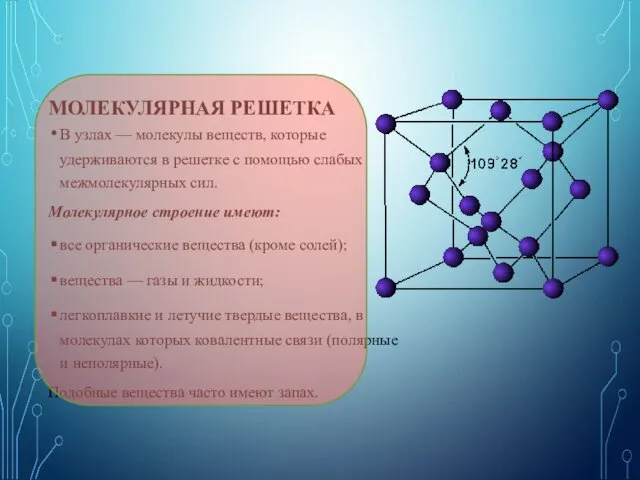
- 32. МОЛЕКУЛЯРНАЯ РЕШЕТКА В узлах — молекулы веществ, которые удерживаются в решетке с помощью слабых межмолекулярных сил.
- 33. Самостоятельная работа на оценку на отдельном листочке
- 35. Скачать презентацию


























 Молодежь и молодежные организации Забайкалья
Молодежь и молодежные организации Забайкалья Современный комплексный подход к оценке здоровья, с использованием метода ПЦР
Современный комплексный подход к оценке здоровья, с использованием метода ПЦР Химический след в литературных произведениях
Химический след в литературных произведениях Предвыборная программа кандидата в студенческий совет. Богдановский Илья
Предвыборная программа кандидата в студенческий совет. Богдановский Илья Приветствие для учителей-математиков на 1 сентября
Приветствие для учителей-математиков на 1 сентября Классный час на тему: День Победы
Классный час на тему: День Победы Презентация к уроку производственного обучения Hair Tattoo
Презентация к уроку производственного обучения Hair Tattoo Презентация по теме ТБ на уроках химии
Презентация по теме ТБ на уроках химии Живая, охлажденная и мороженая рыба
Живая, охлажденная и мороженая рыба Итоги социального проекта Формула жизни
Итоги социального проекта Формула жизни Презентация Зима
Презентация Зима Фёдор Григорьевич Углов
Фёдор Григорьевич Углов Александр Николаевич Островский (1823-1886) – русский драматург
Александр Николаевич Островский (1823-1886) – русский драматург Пернатые гости Диск
Пернатые гости Диск Особо охраняемые природные территории Кировской области
Особо охраняемые природные территории Кировской области Интерактивная физкультминутка Чунга-Чанга
Интерактивная физкультминутка Чунга-Чанга Prezentarea Guțu
Prezentarea Guțu М.ВидеоЭльдорадо. Продажи в магазинах, выполнение плана
М.ВидеоЭльдорадо. Продажи в магазинах, выполнение плана Предмет и метод экономической истории
Предмет и метод экономической истории Современное авиамоделирование
Современное авиамоделирование Обращение. Знаки препинания при обращении
Обращение. Знаки препинания при обращении Консультация для воспитателей развитие мыслительных процессов гиперактивных детей через игру часть1
Консультация для воспитателей развитие мыслительных процессов гиперактивных детей через игру часть1 Презентация по окружающему миру 1 класс Задавайте вопросы
Презентация по окружающему миру 1 класс Задавайте вопросы Презентация к уроку географии 5 класс. Погода и метеорологические наблюдения.
Презентация к уроку географии 5 класс. Погода и метеорологические наблюдения. Латеральное мышление (25)
Латеральное мышление (25) История и методы изучения клетки. Клеточная теория
История и методы изучения клетки. Клеточная теория Сталинградская битва.
Сталинградская битва. Туристические домики Baikal House
Туристические домики Baikal House