Содержание
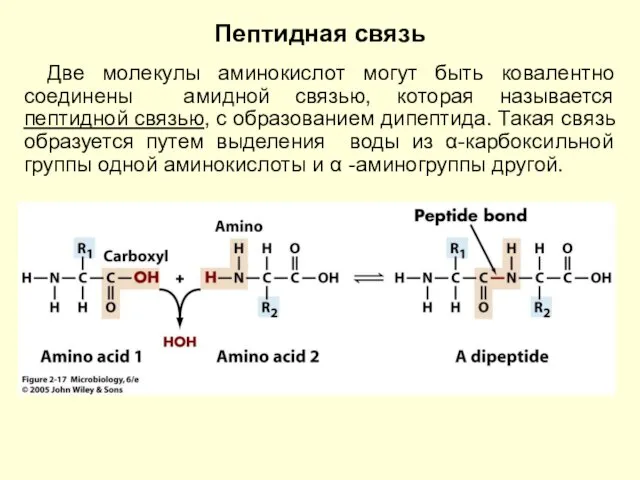
- 2. Пептидная связь Две молекулы аминокислот могут быть ковалентно соединены амидной связью, которая называется пептидной связью, с
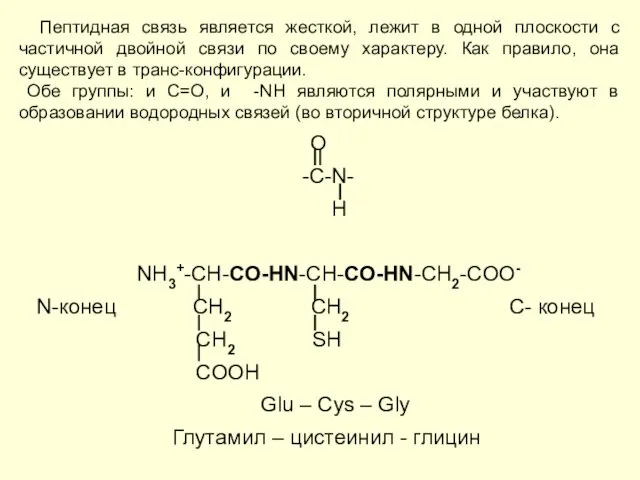
- 3. Пептидная связь является жесткой, лежит в одной плоскости с частичной двойной связи по своему характеру. Как
- 4. Структура окситоцина NH3+- Gly- Leu- Pro - Cys - Asn - Gln - Ile -Tyr –Cys
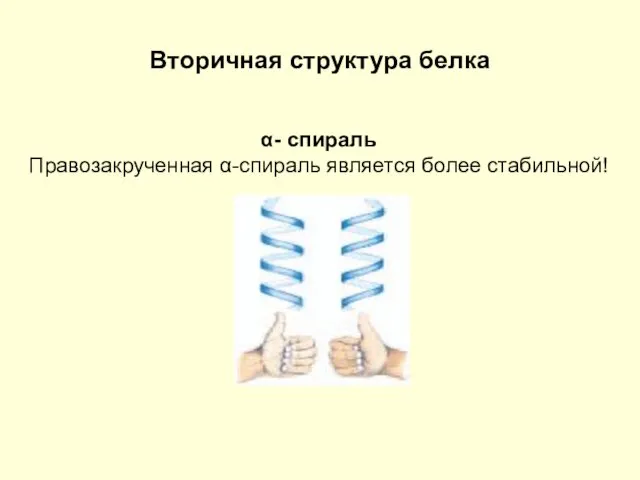
- 5. Вторичная структура белка α- спираль Правозакрученная α-спираль является более стабильной!
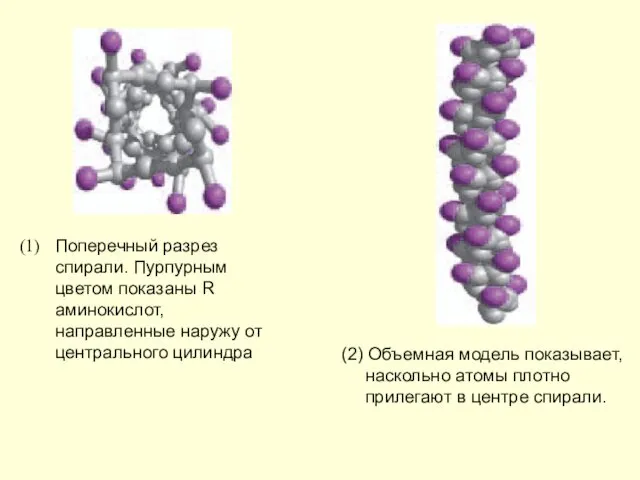
- 6. Поперечный разрез спирали. Пурпурным цветом показаны R аминокислот, направленные наружу от центрального цилиндра (2) Объемная модель
- 7. α-спираль можно представить как линию, плотно обмотанную вокруг цилиндра, с радикалами аминокислот, направленными наружу. α-спираль стабилизируется
- 8. β- складчатые листки Полипептидные цепи в β–листках могут быть параллельны или анти-параллельны. Параллельные : N-конец C-
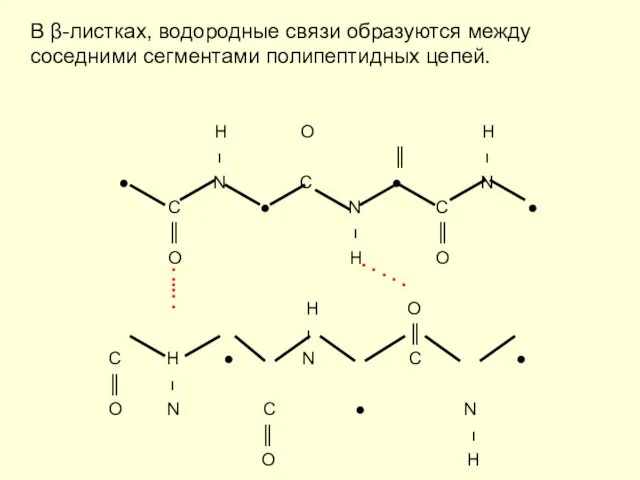
- 9. В β-листках, водородные связи образуются между соседними сегментами полипептидных цепей. H O H ו ║ ו
- 10. (a) Модель Дж. Ричардсон. Третичная структура белка (b) Объемная модель со всеми боковые радикалами аминокислот. Каждый
- 11. Четвертичная структура белка Некоторые белки состоят из двух и более полипептидов, которые могут быть одинаковыми или
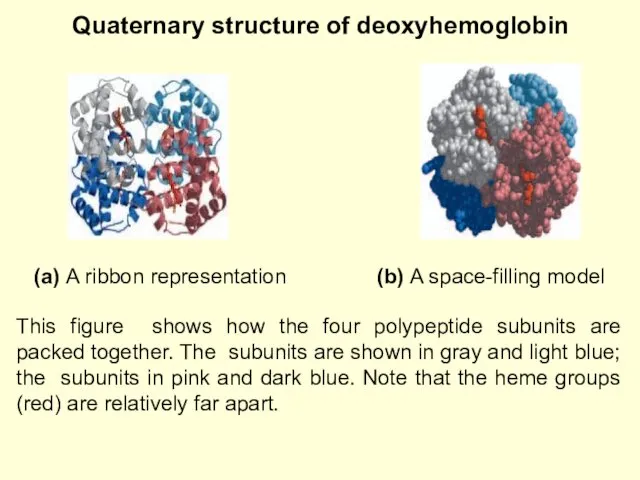
- 12. Quaternary structure of deoxyhemoglobin This figure shows how the four polypeptide subunits are packed together. The
- 13. Денатурация белка Явление дезорганизации нативной структуры белка известно как денатурация. Оно проявляется в потере вторичной, третичной
- 14. Характеристика денатурации Теряется нативная структура белка. Первичная структура белка с пептидной связью сохраняется. Белки теряют свою
- 16. Скачать презентацию







 Никитин Рубин Казань
Никитин Рубин Казань Презентация: из истории Памятника Архитектуры и культуры Краснодарского края Свято-Троицкого храма ст. Платнировской. 1906 - 2011
Презентация: из истории Памятника Архитектуры и культуры Краснодарского края Свято-Троицкого храма ст. Платнировской. 1906 - 2011 Консультация для педагогов Толерантность
Консультация для педагогов Толерантность Густав Роберт Кирхгов
Густав Роберт Кирхгов Гробница Тутанхамона. История открытия
Гробница Тутанхамона. История открытия Построение розы ветров
Построение розы ветров класс тематический натюрморт
класс тематический натюрморт Мотивация деятельности человека
Мотивация деятельности человека Когортные исследования
Когортные исследования Музыкальная физкультминутка
Музыкальная физкультминутка Кремний и его соединения
Кремний и его соединения پروژه ساعت سون سگمنت
پروژه ساعت سون سگمنت Презентации к уроку естествознания
Презентации к уроку естествознания Радиомаяк азимутальный РМА–90. Аппаратура управления и проверки
Радиомаяк азимутальный РМА–90. Аппаратура управления и проверки Философия и ее роль в жизни общества
Философия и ее роль в жизни общества Sonic Theology
Sonic Theology Формы государства
Формы государства Коррекционно-развивающие программы, методики и технологии работы с детьми раннего возраста
Коррекционно-развивающие программы, методики и технологии работы с детьми раннего возраста ВИДЫ СВЯЗИ
ВИДЫ СВЯЗИ Библейские аллюзии в сериале Люцифер
Библейские аллюзии в сериале Люцифер Александр II: начало правления. Крестьянская реформа 1861 г
Александр II: начало правления. Крестьянская реформа 1861 г Особенности туризма как объекта управления
Особенности туризма как объекта управления Ядролық энергетикалық қондырғылар
Ядролық энергетикалық қондырғылар Роль методического объединения классных руководителей в современной школе
Роль методического объединения классных руководителей в современной школе Игра для ЭОР
Игра для ЭОР Наша свадьба год назад
Наша свадьба год назад Презентация
Презентация Край родной-Талдомский
Край родной-Талдомский