Содержание
- 2. Характеристика элемента по положению в системе и строению атома Распространение в природе Физические свойства Аллотропия Химические
- 3. Расположение в системе и строение атома Si - элемент №14, 3 период, IV А группа, Ar(Si)=28.
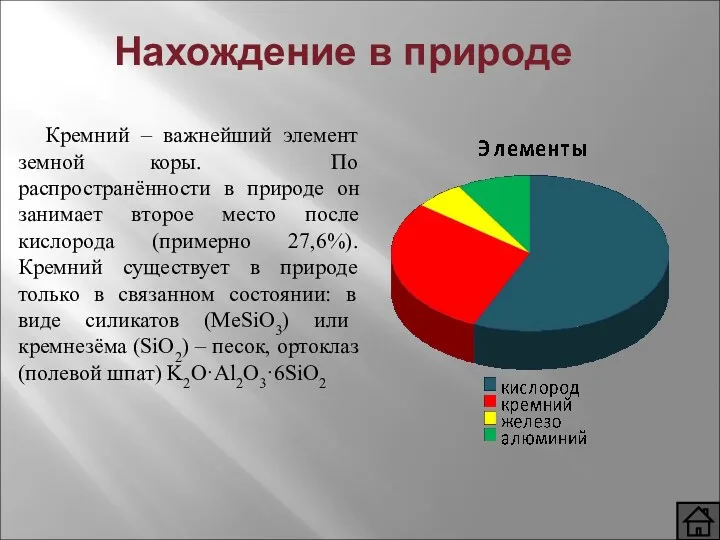
- 4. Нахождение в природе Кремний – важнейший элемент земной коры. По распространённости в природе он занимает второе
- 5. Отделочные и полудрагоценные камни Яшма Агат
- 6. Физические свойства Кристаллический кремний Тёмно-серого цвета, имеет металлический блеск, полупроводниковые свойства Химически инертен. Плотность 2,33 г/см3
- 7. Химические свойства Si + 2F2 → SiF4 (фторид кремния) Si + 2Cl2 → SiCl4 (хлорид кремния)
- 8. При сплавлении кремния с металлами могут образоваться силициды Как окислитель Si + 2Mg → Mg2Si (Силицид
- 9. Способы получения кремния В лаборатории – восстановлением SiO2 + 2C → Si + 2CO↑ SiO2 +
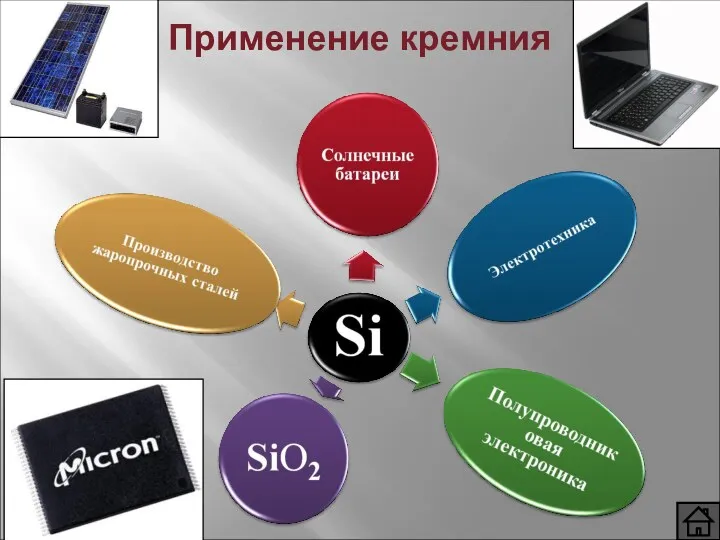
- 10. Применение кремния
- 11. Оксид кремния IV (SiO2)n Кварц Кристобалит Коусит Горный хрусталь Агат Яшма опал Кварцевый песок В природе
- 12. Со щелочами при t⁰ SiO2 + 2NaOH → Na2SiO3 + H2O С солями SiO2 + CaCO3
- 13. Кремниевая кислота. Силикаты nSiO2 ∙ mH2O поликремниевые кислоты N = 1, m = 1 SiO2 ∙
- 15. Скачать презентацию










 Презентация к празднику осени Осенний переполох
Презентация к празднику осени Осенний переполох История празднования Нового года в России
История празднования Нового года в России Формирование навыков самоконтроля и самооценки как важный фактор повышения качества образования младших школьников
Формирование навыков самоконтроля и самооценки как важный фактор повышения качества образования младших школьников Методы обработки внутренних поверхностей
Методы обработки внутренних поверхностей Стихотворение Г.Рублева Памятник
Стихотворение Г.Рублева Памятник Родительское собрание для будущих первоклассников.
Родительское собрание для будущих первоклассников. Объёмная и подвижная аппликация. Воспоминания о море. Корабль и парусник. Техника оригами.
Объёмная и подвижная аппликация. Воспоминания о море. Корабль и парусник. Техника оригами. Пословицы и поговорки о труде
Пословицы и поговорки о труде Изучение машин и оборудования для организации рельефа и производства дорожных работ
Изучение машин и оборудования для организации рельефа и производства дорожных работ Проблема периодизации психического развития в отечественной и зарубежной психологии
Проблема периодизации психического развития в отечественной и зарубежной психологии Знакомство с Интернетом. Браузеры. Безопасная работа в Интернете. 7 класс
Знакомство с Интернетом. Браузеры. Безопасная работа в Интернете. 7 класс Обозначение парных глухих и звонких согласных звуков на конце слова
Обозначение парных глухих и звонких согласных звуков на конце слова Устная часть. Подготовка к заданию 1. ЕГЭ по английскому языку. Чтение вслух
Устная часть. Подготовка к заданию 1. ЕГЭ по английскому языку. Чтение вслух Условные предложения в английском языке. Conditionals
Условные предложения в английском языке. Conditionals Презентация Что умеют повара
Презентация Что умеют повара Презентация (ХОР)
Презентация (ХОР) Найди домик звуку. Игра №1
Найди домик звуку. Игра №1 История развития химических наук
История развития химических наук Техническая подготовка. Радиостанции малой мощности. Возимая радиостанция малой мощности УКВ диапазона Р-173. (Тема 2.4)
Техническая подготовка. Радиостанции малой мощности. Возимая радиостанция малой мощности УКВ диапазона Р-173. (Тема 2.4) Модели сестринского ухода
Модели сестринского ухода Кавказский биосферный заповедник
Кавказский биосферный заповедник Грыжи межпозвонковых дисков
Грыжи межпозвонковых дисков Особенности логопедической работы с детьми с ОВЗ
Особенности логопедической работы с детьми с ОВЗ Проектная деятельность во внеурочной работе .1 класс Б.Символ 2014 года - лошадка.2 четверть
Проектная деятельность во внеурочной работе .1 класс Б.Символ 2014 года - лошадка.2 четверть Лекція 1. Алгоритми та основні поняття
Лекція 1. Алгоритми та основні поняття Табиғи консервілерді метрологиялық қамтамасыз ету. Жасыл бұршақ консервісі
Табиғи консервілерді метрологиялық қамтамасыз ету. Жасыл бұршақ консервісі Основные определения
Основные определения Политическая культура Красноярского края
Политическая культура Красноярского края