Содержание
- 2. Радикалы Свободный радикал - это молекулярная частица (атом или молекула), имеющая на внешней электронной оболочке один
- 3. Молекула кислорода (диоксиген) содержит на внешней оболочке два неспаренных электрона. Диоксиген – это бирадикал и, подобно
- 4. Неспаренный электрон в радикалах принято обозначать точкой. Радикал гидроксила - HO˙, радикал пероксида водорода - HOO˙,
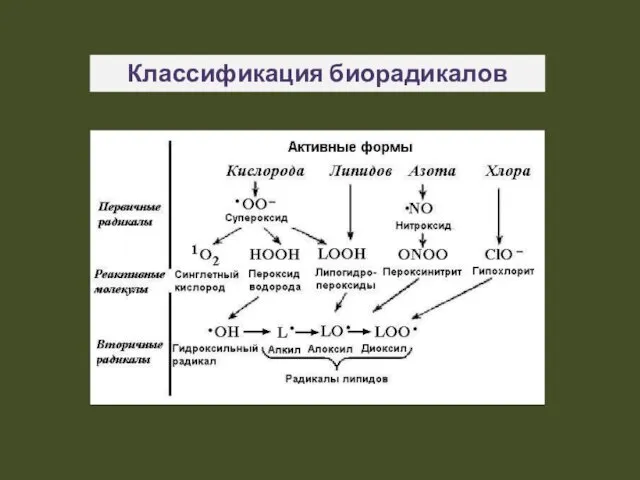
- 5. Все радикалы, образующиеся в организме, можно разделить на: природные и чужеродные; первичные (могут быть полезными), вторичные
- 6. Классификация биорадикалов
- 7. Образование и роль биорадикалов У всех аэробных организмов супероксидный анион-радикал кислорода, гидроксильный радикал, пероксид водорода, монооксид
- 8. Пути образования биорадикалов в организме можно разделить на две группы: физиологически значимые пути; нефизиологические пути. Деление
- 9. Физиологические механизмы реализации бактерицидного действия АФК: участие в образовании активных оксидантов в реакции Хабера- Вейса. Вносят
- 10. вовлечение пероксида водорода в реакции, катализируемые миелопероксидазой (МПО), в результате образуюся активные формы хлора, в первую
- 11. реакция анион-радикала кислорода с моноокисдом азота и образование пероксинитрита. NO образуется из L- аргинина в результате
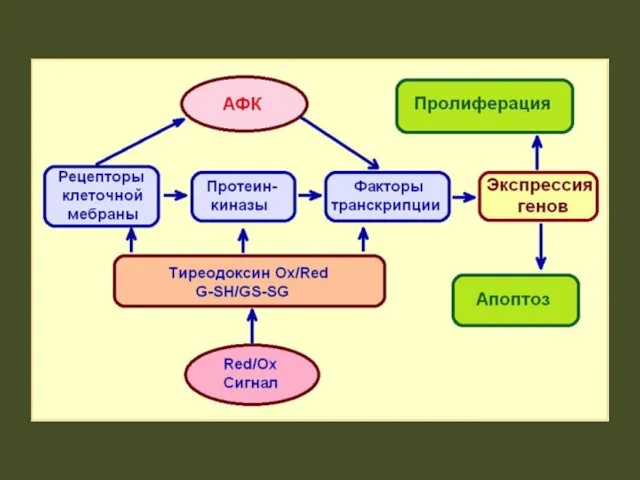
- 12. Кроме бактерицидного действия ˙ОН участвует в сборке и разборке биологических мембран, запуске митогенеза, процессах клеточной пролиферации
- 13. 2. Механизмы нефизиологической продукции биорадикалов в оганизме: окисление органических соединений, в первую очередь фенолов и полифенолов;
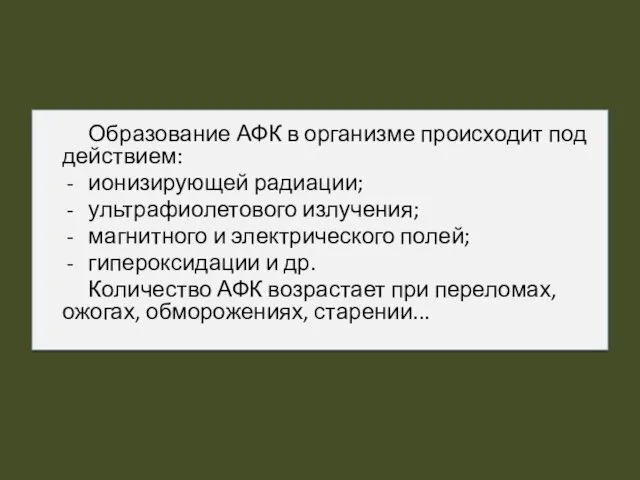
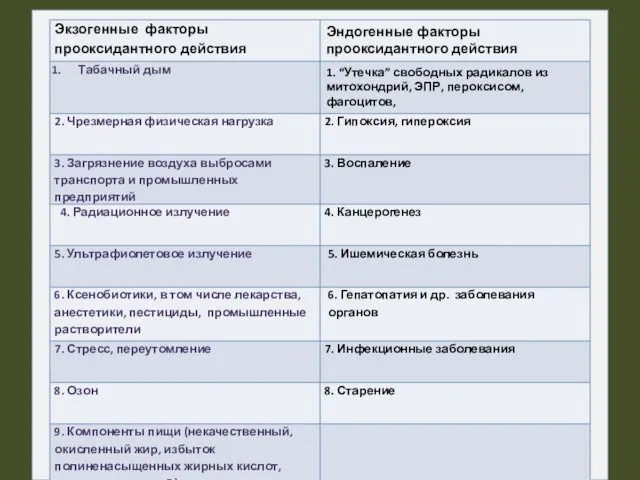
- 14. Образование АФК в организме происходит под действием: ионизирующей радиации; ультрафиолетового излучения; магнитного и электрического полей; гипероксидации
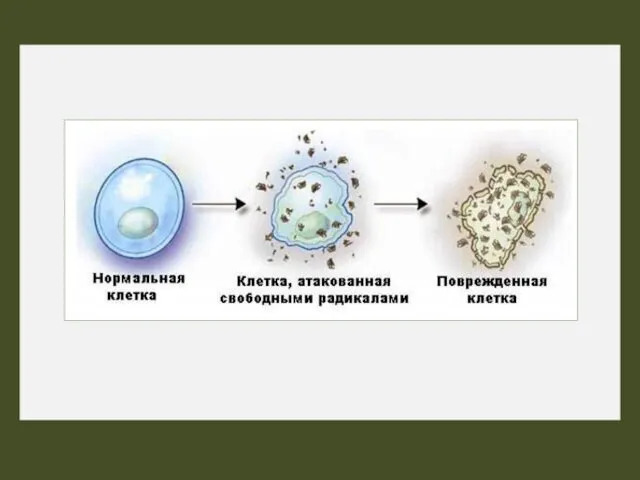
- 15. Окислительный стресс (оксидативный стресс, от англ. oxidative stress) — процесс повреждения клетки в результате окисления. Оксидативный
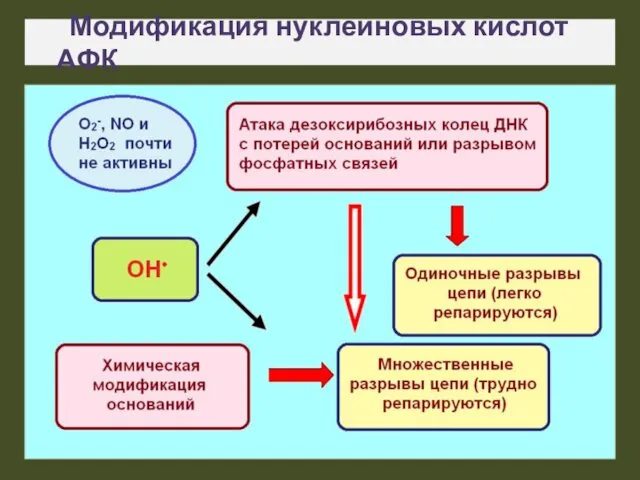
- 17. Модификация нуклеиновых кислот АФК
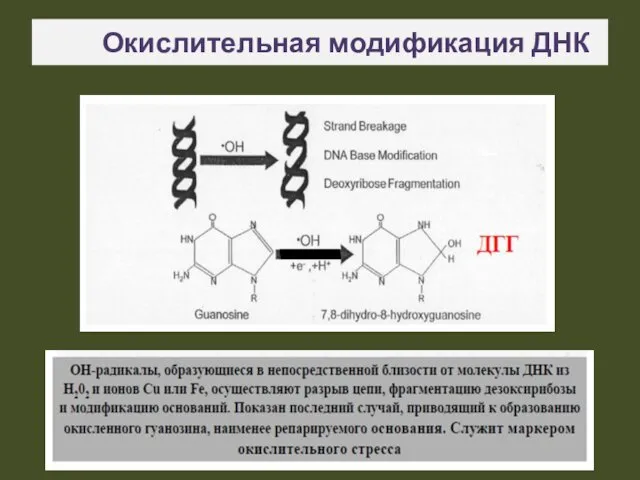
- 18. Окислительная модификация ДНК
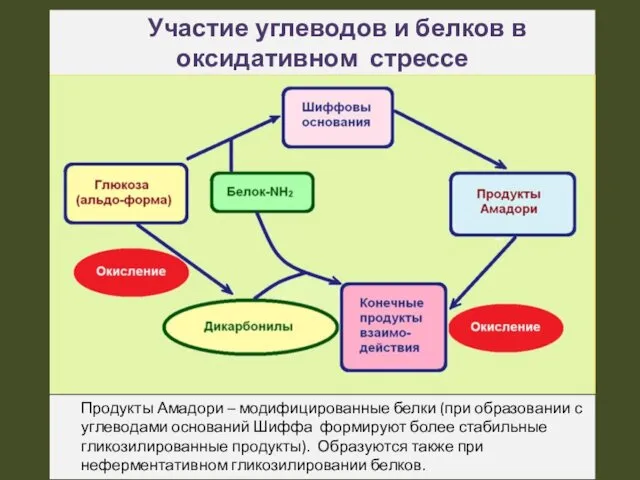
- 19. Участие углеводов и белков в оксидативном стрессе Продукты Амадори – модифицированные белки (при образовании с углеводами
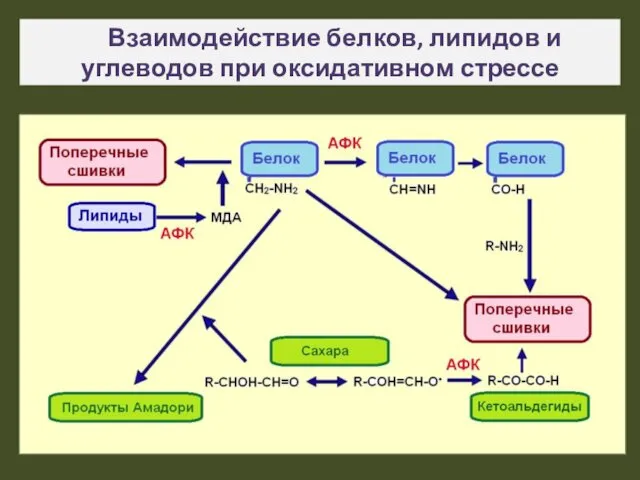
- 20. Взаимодействие белков, липидов и углеводов при оксидативном стрессе
- 21. Важное значение играет процесс, протекающий в организме под действием свободных радикалов – процесс перекисного окисления липидов
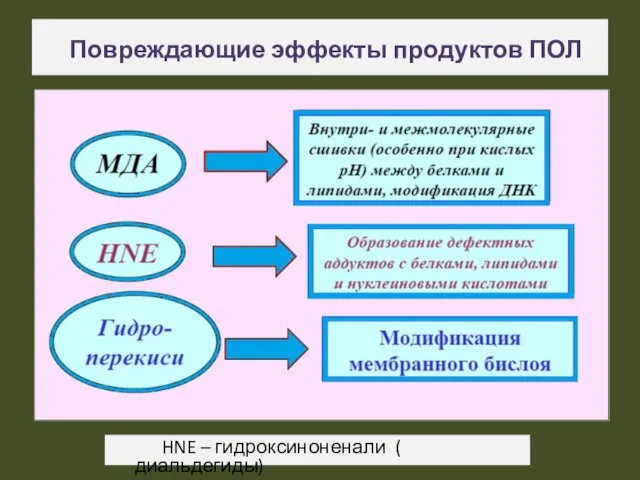
- 22. Повреждающие эффекты продуктов ПОЛ HNE – гидроксиноненали ( диальдегиды)
- 23. Потеря контроля над АФК в организме и развитие оксидативного стресса, способствует появлению более 100 различных заболеваний.
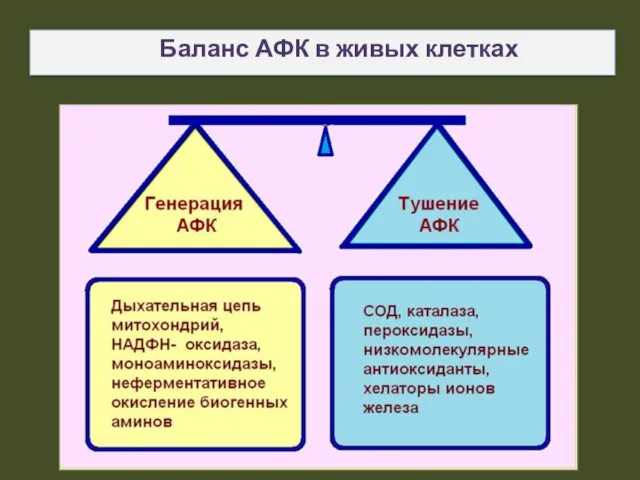
- 25. Баланс АФК в живых клетках
- 26. Антиоксидантная система Природа создала сложную антиоксидантную систему, способную нейтрализовать свободные радикалы, возникающие в результате обмена веществ,
- 27. Факторы антиоксидантной защиты клеток Единой универсальной классификации антиоксидантов нет. Высказывается точка зрения о нескольких уровнях защиты
- 28. Некоторыми авторами предпринята следующая попытка классификации антиоксидантов (2 группы). 1. Высокомолекулярные соединения: - ферменты антиоксидантной защиты
- 29. белки, способные связывать ионы Fe и Cu, являющиеся катализаторами свободнорадикальных процессов. К их числу относят альбумины
- 30. Ферментативная защита Супероксиддисмутаза (СОД; КФ 1.15.1.1.) катализирует реакцию восстановления анион радикала кислорода (·О2-) до пероксида водорода,
- 31. В клетках эукариот СОД имеет несколько форм: а) медь и цинксодержащая СОД – локализована в цитозоле,
- 32. Каталаза (Кат.; КФ 1.11.1.6) обладает свойствами разлагать пероксид водорода по двум путям: каталазному или пероксидазному. В
- 33. Пероксидазы — подкласс геминовых ферментов. Восстанавливают пероксид водорода до H2O, при этом обязательно идет окисление восстановителя.
- 34. Наряду с «классической» селен-зависимой глутатионпероксидазой, в организме присутствует ряд других ферментов, выполняющих сходную функцию, это –
- 35. Важную роль в поддержании редокс-баланса в клетке играют - тиоредоксины, глутаредоксины и пероксиредоксины. -
- 36. Тиоредоксины (TRX) – полифункциональные низкомолекулярные белки, имеющие в своей структуре двухцистеиновый участок и образующие при окислении
- 38. Пероксиредоксины (тиоредоксиновые пероксидазы)— широкораспространенное семейство неселеновых антиоксидантных ферментов. В отличие от тиоредоксинов, не имеют двухцистеиновых участков.
- 39. Главная функция пероксиредоксинов – восстановление и детоксикация Н2О2, органических гидропероксидов и пероксинитрита. У млекопитающих, например, контролируют
- 40. Глутаредоксины – Г-SH-зависимые полифункциональные оксидоредуктазы с низкой молекулярной массой (9-14 kДa). В отличие от тиоредоксинов имеют
- 41. Неферментативные компоненты антиоксидантной системы По механизму действия могут быть классифицированы на следующие группы: классические антиоксиданты (обрывающие
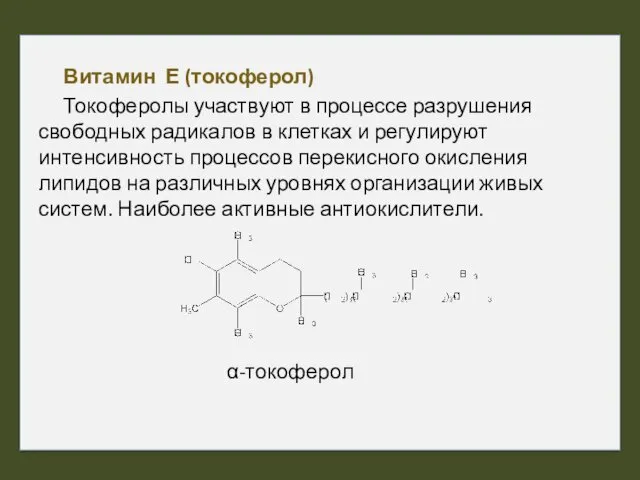
- 42. Витамин Е (токоферол) Токоферолы участвуют в процессе разрушения свободных радикалов в клетках и регулируют интенсивность процессов
- 43. α-Токоферол способен реагировать с АФК и радикалами жирных кислот. В реакции принимает участие ОН-группа фенольного ядра,
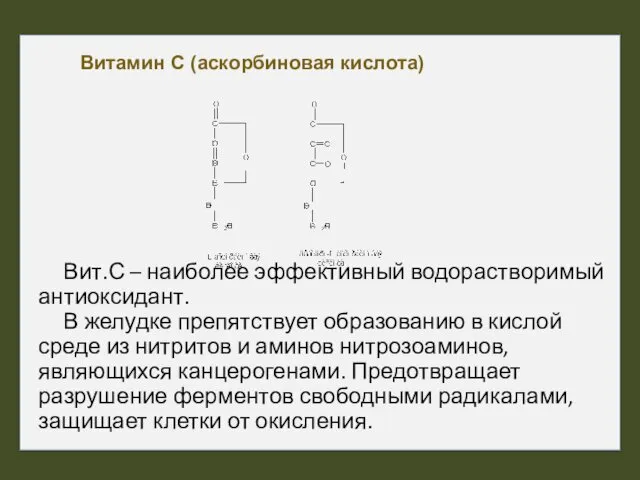
- 44. Витамин С (аскорбиновая кислота) Вит.С – наиболее эффективный водорастворимый антиоксидант. В желудке препятствует образованию в кислой
- 45. Вит. С участвует в окислительно-восстановительных реакциях, защищая гемоглобин от окисления, способствует синтезу коллагена (реакции гидроксилирования), обеспечивает
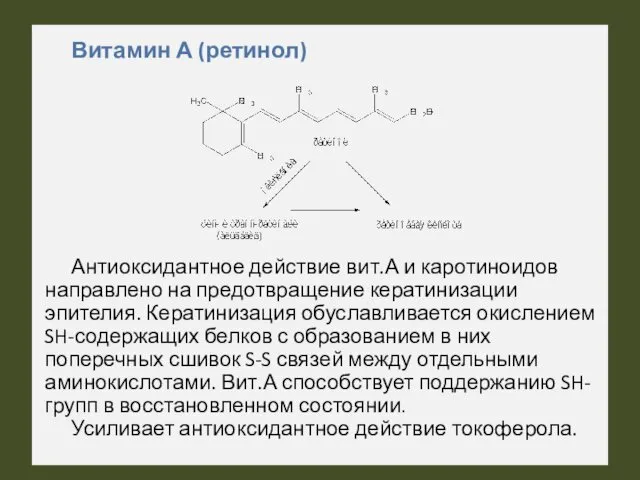
- 46. Витамин А (ретинол) Антиоксидантное действие вит.А и каротиноидов направлено на предотвращение кератинизации эпителия. Кератинизация обуславливается окислением
- 47. Флавоноиды эффективно нейтрализуют радикалы, благодаря наличию гидроксильных и карбонильных групп. Способны акцептировать свободные радикалы и хелатировать
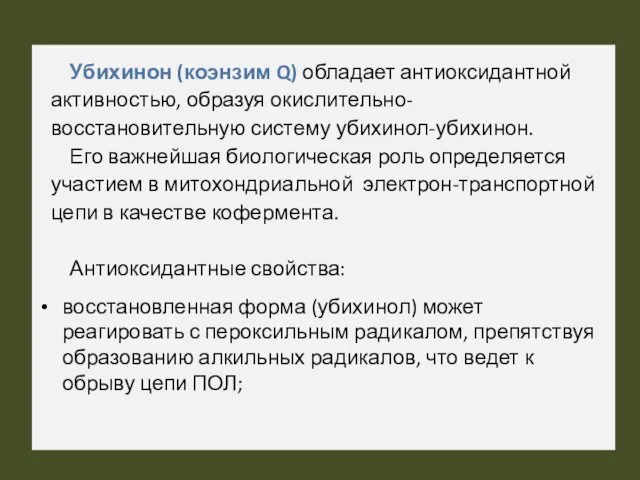
- 48. Убихинон (коэнзим Q) обладает антиоксидантной активностью, образуя окислительно-восстановительную систему убихинол-убихинон. Его важнейшая биологическая роль определяется участием
- 49. обеспечивает эффективную защиту мембранных липидов, белков и ДНК от действия АФК; восстанавливает витамин Е, взаимодействуя с
- 50. Высокая антиокислительная активность выявлена у некоторых гормонов, в частности, содержащих фенольную группу эстрогенов (женских половых гормонов)
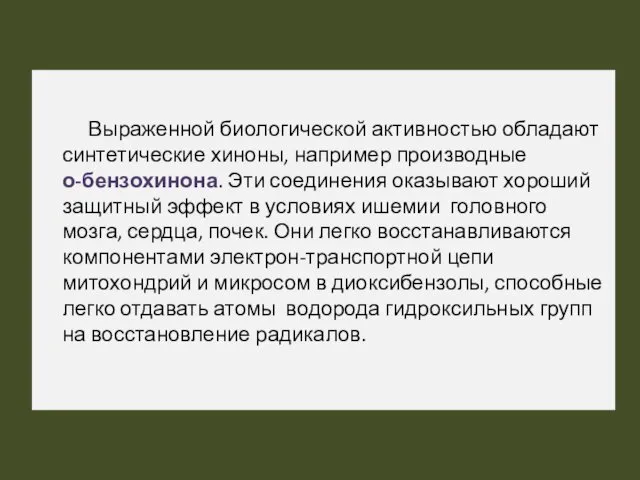
- 51. Выраженной биологической активностью обладают синтетические хиноны, например производные о-бензохинона. Эти соединения оказывают хороший защитный эффект в
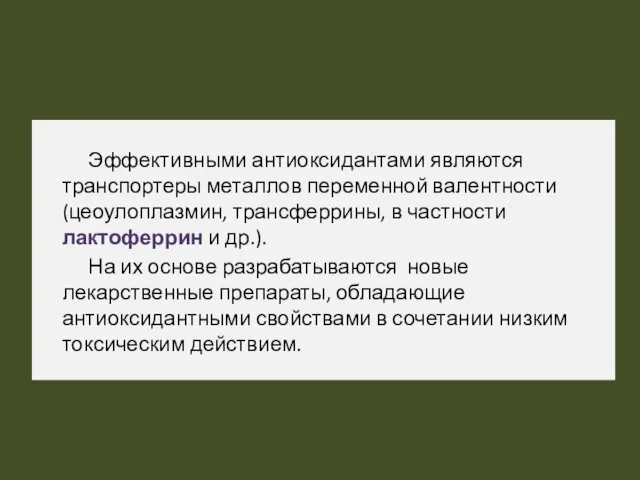
- 52. Эффективными антиоксидантами являются транспортеры металлов переменной валентности (цеоулоплазмин, трансферрины, в частности лактоферрин и др.). На их
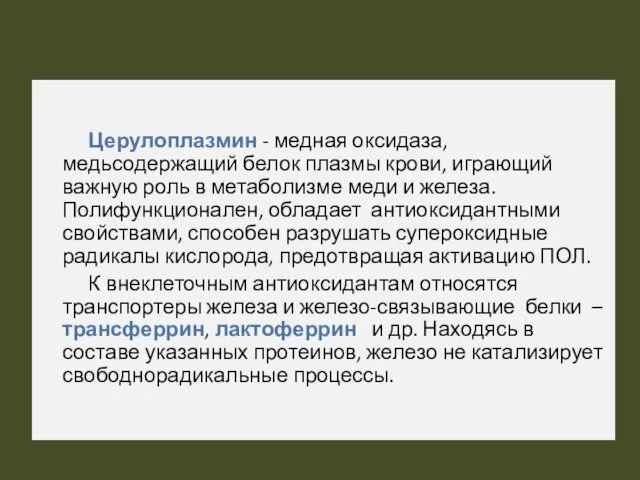
- 53. Церулоплазмин - медная оксидаза, медьсодержащий белок плазмы крови, играющий важную роль в метаболизме меди и железа.
- 55. Скачать презентацию
































 Современные технологии, методы проектирования и строительства объектов
Современные технологии, методы проектирования и строительства объектов Организация проектирования и строительства горных предприятий
Организация проектирования и строительства горных предприятий Коллоидные системы. Виды осветлительных фильтров. Развитие мембранных технологий
Коллоидные системы. Виды осветлительных фильтров. Развитие мембранных технологий Проектировщик инфраструктуры умного дома
Проектировщик инфраструктуры умного дома Военачальники Великой Отечественной войны
Военачальники Великой Отечественной войны Экономическое чудо Японии
Экономическое чудо Японии Пр.р Цифровизация(1)
Пр.р Цифровизация(1) Выпрямительные диоды
Выпрямительные диоды Микроконтроллердің құрылымы
Микроконтроллердің құрылымы Машина Тьюринга
Машина Тьюринга Компетентностный подход в работе с персоналом. Компетенции работников образовательного учреждения и бизнес-компетенции
Компетентностный подход в работе с персоналом. Компетенции работников образовательного учреждения и бизнес-компетенции Михаил Васильевич Ломоносов (1711-1765)
Михаил Васильевич Ломоносов (1711-1765) Бактерии в геохимических круговоротах. Водная микробиология, первичная продукция водоемов
Бактерии в геохимических круговоротах. Водная микробиология, первичная продукция водоемов Теплоснабжение
Теплоснабжение Ноотропы, адаптогены, актопротекторы. Средства, устраняющие спазм мозговых сосудов
Ноотропы, адаптогены, актопротекторы. Средства, устраняющие спазм мозговых сосудов урок технологии РОЗЫ ИЗ ПЛАСТИЛИНА
урок технологии РОЗЫ ИЗ ПЛАСТИЛИНА Роль методической службы образовательного учреждения в создании комплекса условий для развития профессиональной компетентности педагогических работников
Роль методической службы образовательного учреждения в создании комплекса условий для развития профессиональной компетентности педагогических работников классный час ЗОЖ
классный час ЗОЖ Австрийская республика
Австрийская республика Тема поэта и поэзии в творчестве А. С. Пушкина
Тема поэта и поэзии в творчестве А. С. Пушкина Презентации по технологии
Презентации по технологии МОЯ ВИЗИТНАЯ КАРТОЧКА
МОЯ ВИЗИТНАЯ КАРТОЧКА Презентация к уроку О чем звонят колокола
Презентация к уроку О чем звонят колокола Алгоритм деления трёхзначного числа на однозначное
Алгоритм деления трёхзначного числа на однозначное Базирование заготовок
Базирование заготовок Создание мультфильма
Создание мультфильма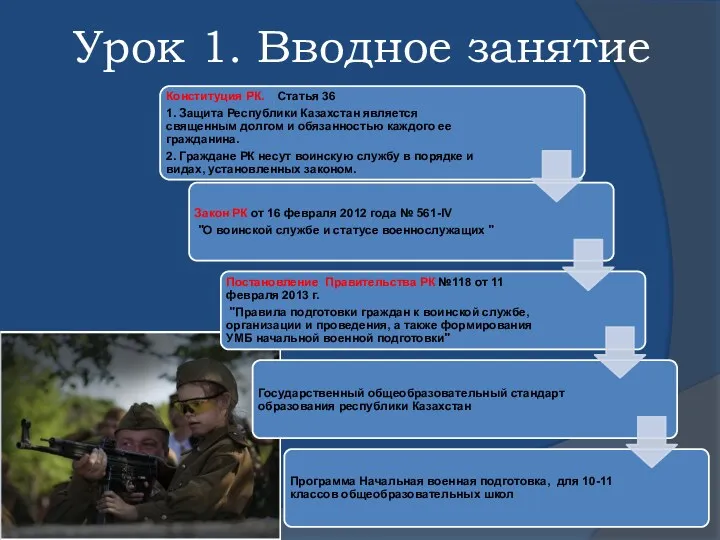 Презентация к уроку Вводное занятие
Презентация к уроку Вводное занятие КОМПЬЮТЕРНАЯ ПРЕЗЕНТАЦИЯ ПО ГЕОГРАФИИ Лесной комплекс Россииии 9 КЛАСС
КОМПЬЮТЕРНАЯ ПРЕЗЕНТАЦИЯ ПО ГЕОГРАФИИ Лесной комплекс Россииии 9 КЛАСС