Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и процессов окисления-восстановления презентация
Содержание
- 2. Химические свойства Оксидов Кислот Оснований Солей
- 3. Оксиды состоят из двух элементов, один из которых – кислород В состав оксида может входить как
- 4. Кислотный оксид Основный оксид Валентность Валентность > IV Кислотный оксид
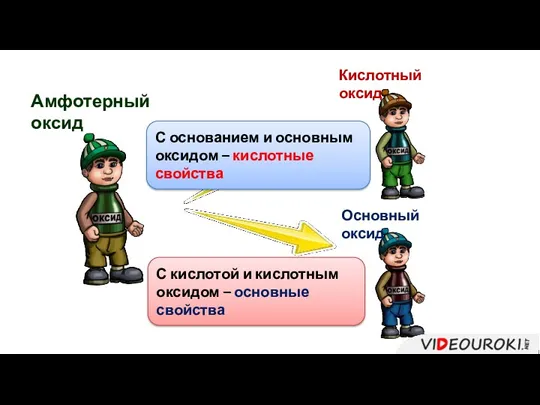
- 5. Амфотерный оксид Кислотный оксид Основный оксид С кислотой и кислотным оксидом – основные свойства С основанием
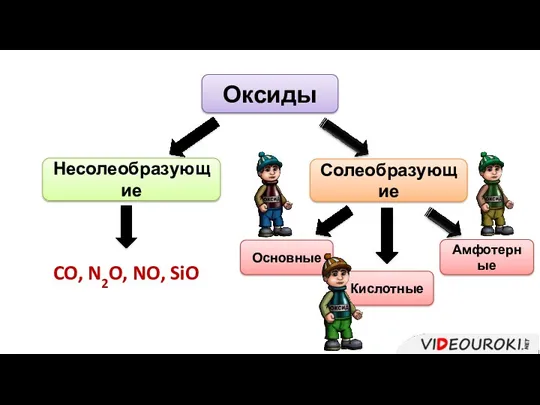
- 6. Оксиды Несолеобразующие Солеобразующие CO, N2O, NO, SiO Основные Амфотерные Кислотные
- 7. Несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями и не образуют солей
- 8. Основный оксид Основный оксид + кислота = соль + вода
- 9. CuO + H2SO4 = CuSO4 + H2O CuO + 2H+ = Cu2+ + H2O Реакция основных
- 10. 3Na2O + P2O5 = 2Na3PO4 MgO + SO3 = MgSO4 CaO + CO2 = CaCO3 Реакция
- 11. Реакция основных оксидов с водой CaO + H2O = Ca(OH)2 Основный оксид + вода = основание
- 12. Основный оксид + кислота = соль + вода Кислотный оксид
- 13. CO2 + Ca(OH)2 = CaCO3↓ + H2O CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O
- 14. Кислотные оксиды реагируют с основными оксидами с образованием солей
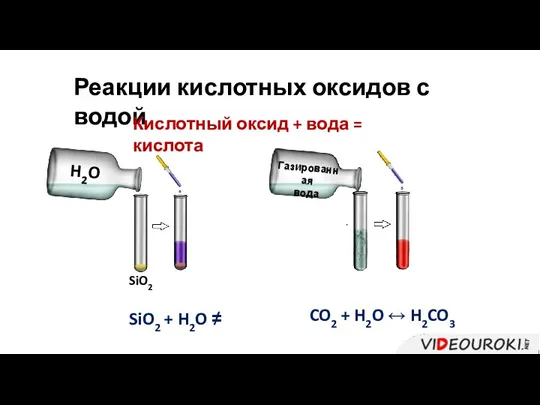
- 15. Реакции кислотных оксидов с водой Кислотный оксид + вода = кислота SiO2 + H2O ≠ CO2
- 16. Амфотерные оксиды реагируют и с кислотами, и с основаниями
- 17. ZnO + 2HCl = ZnCl2 + H2O ZnO + 2NaOH + H2O = Na2[Zn(OH)4] ZnO +
- 18. Окрашивают лакмус и метиловый оранжевый в красный цвет При диссоциации образуют ионы водорода HCl = H+
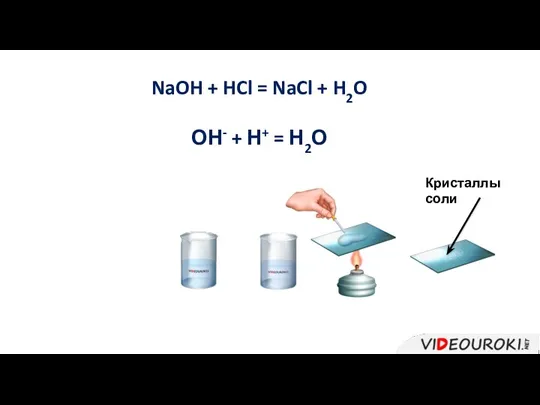
- 19. NaOH + HCl = NaCl + H2O ОН- + Н+ = Н2О Кристаллы соли
- 20. Fe(OH)3 + 3HCl = FeCl3 + 3H2O Fe(OH)3 + 3H+ = Fe3+ + 3H2O Кристаллы соли
- 21. Кислоты вступают в реакции обмена с основными оксидами В результате реакции образуется соль и вода
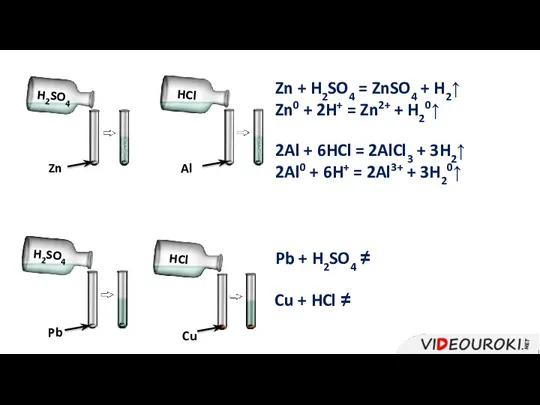
- 22. Кислоты реагируют с металлами Это реакции замещения При этом образуется соль и водород
- 23. Для этих реакций необходимы условия: Металл должен находиться в ряду напряжений до водорода; Должна получиться растворимая
- 24. Zn H2SO4 Al HCl H2SO4 Pb Cu HCl Zn + H2SO4 = ZnSO4 + H2↑ Zn0
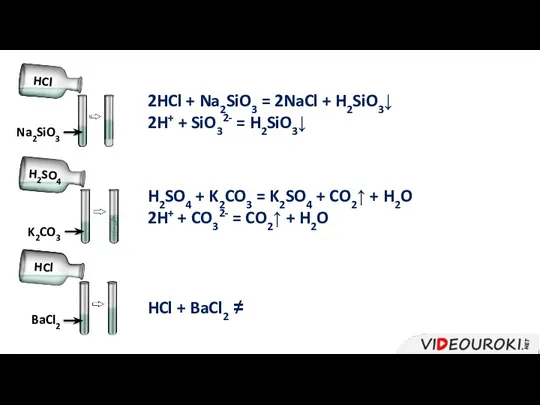
- 25. Кислоты вступают в реакции обмена с солями При этом образуется новая кислота и новая соль Реакция
- 26. HCl Na2SiO3 H2SO4 K2CO3 HCl BaCl2 2HCl + Na2SiO3 = 2NaCl + H2SiO3↓ 2H+ + SiO32-
- 27. Содержат гидроксогруппу Окрашивают лакмус в синий цвет Окрашивают метиловый оранжевый в жёлтый цвет Окрашивают фенолфталеин в
- 28. Щёлочи – растворимые в воде основания Вступают в реакцию нейтрализации с кислотами Щёлочи реагируют с кислотными
- 29. Реакции с амфотерными основаниями Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] тетрагидроксоцинкат натрия Zn(OH)2 + 2NaOH = Na2ZnO2
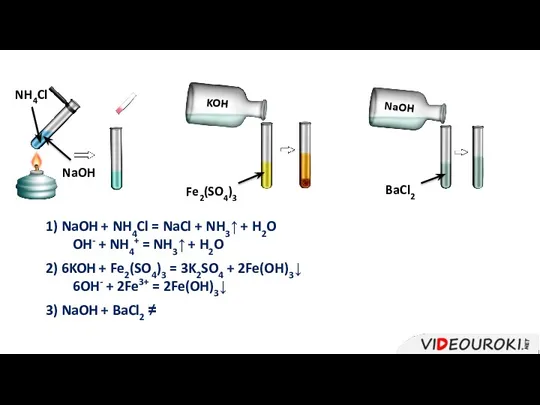
- 30. Щёлочи вступают в реакцию обмена с солями Образуется новая соль и новое основание Должен образоваться осадок
- 31. NH4Cl Fe2(SO4)3 KOH NaOH BaCl2 NaOH 1) NaOH + NH4Cl = NaCl + NH3↑ + H2O
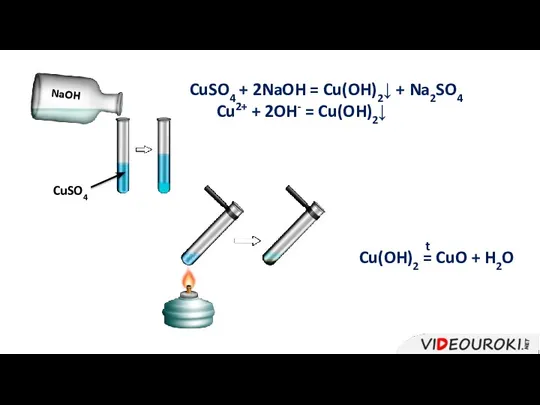
- 32. Нерастворимые основания при нагревании разлагаются Щёлочи при нагревании не разлагаются
- 33. CuSO4 NaOH CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 Cu2+ + 2OH- = Cu(OH)2↓ Cu(OH)2 =
- 34. Соли – особый класс При диссоциации образуют катионы металла и анионы кислотного остатка
- 35. Соли реагируют друг с другом с образованием новых солей В реакциях с кислотами образуется более слабая
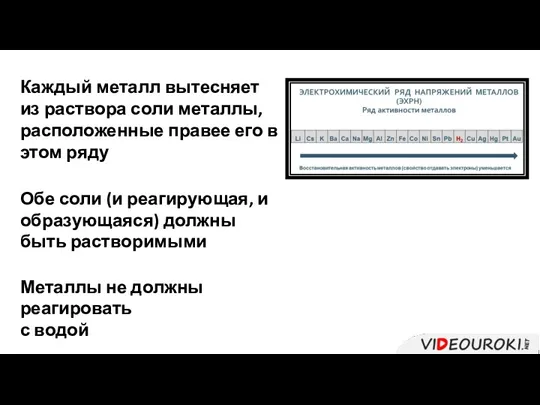
- 36. Соли реагируют с металлами Для этого нужно использовать ряд активности металлов
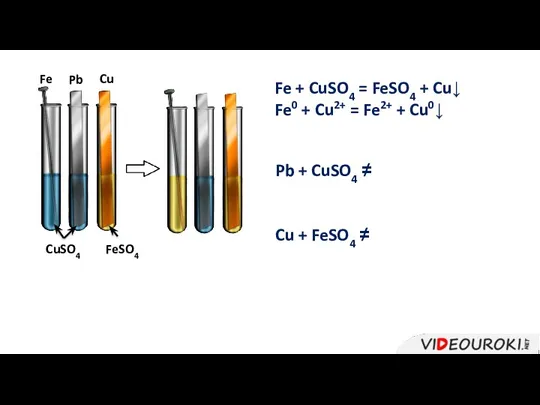
- 37. Каждый металл вытесняет из раствора соли металлы, расположенные правее его в этом ряду Обе соли (и
- 38. Pb Fe Cu CuSO4 FeSO4 Fe + CuSO4 = FeSO4 + Cu↓ Fe0 + Cu2+ =
- 39. Известны ли вам дети Какие есть оксиды на планете? У оксидов пристрастия разные То кислоты им
- 40. Кислотные оксиды А эти спешат к основаниям, Растворимые, очень желанные, Но с водой дружбу водят не
- 41. Без нас и удобрений нет. Мы состоим из двух частей: Во-первых, водород, о’кей! Во-вторых, остаток наш.
- 42. Щёлочи Мы – жители непростые, Нас очень много на Земле! Особым даром обладая, Мы растворяемся в
- 44. Скачать презентацию





















![Реакции с амфотерными основаниями Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] тетрагидроксоцинкат](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/53848/slide-28.jpg)









 Boeing 747
Boeing 747 Текстовые задачи ОГЭ 9 класс
Текстовые задачи ОГЭ 9 класс правила поведения на воде
правила поведения на воде Школьная газета ноябрь - декабрь 2020 года, школа №8 г. Туймазы
Школьная газета ноябрь - декабрь 2020 года, школа №8 г. Туймазы 20231011_shkolnyy_proekt
20231011_shkolnyy_proekt Соединение брусков
Соединение брусков Смысловые частицы
Смысловые частицы Скит преподобного Саввы. Храм преподобного Саввы Сторожевского
Скит преподобного Саввы. Храм преподобного Саввы Сторожевского Изготовление открытки в технике холодного батика. Призентация.
Изготовление открытки в технике холодного батика. Призентация. Презентация Как зовут тебя, дружок?
Презентация Как зовут тебя, дружок? С новым годом
С новым годом Введение в неврологию. Классификация нервной системы, ее значение в деятельности организма. Нейрон, нейроглия
Введение в неврологию. Классификация нервной системы, ее значение в деятельности организма. Нейрон, нейроглия Christmas in Great Britain
Christmas in Great Britain презентация к уроку природоведения 5 класс тема : Что нужно знать, чтобы вырастить различные виды растений.
презентация к уроку природоведения 5 класс тема : Что нужно знать, чтобы вырастить различные виды растений. Молочный цех для переработки молока в условиях ТОО Отес- Акдала
Молочный цех для переработки молока в условиях ТОО Отес- Акдала Перу
Перу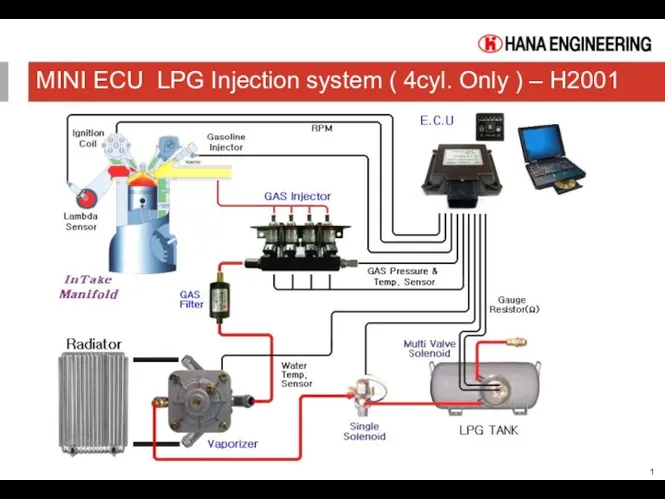 MINI ECU LPG Injection system (4cyl. Only) – H2001
MINI ECU LPG Injection system (4cyl. Only) – H2001 Биомеханическая характеристика силовых качеств
Биомеханическая характеристика силовых качеств Halloween flashcards fun
Halloween flashcards fun Клеточная инженерия в селекции садовых культур. Методы генной инженерии растений. Генетическая трансформация растений
Клеточная инженерия в селекции садовых культур. Методы генной инженерии растений. Генетическая трансформация растений Снежинки и схемы вырезания. Диск
Снежинки и схемы вырезания. Диск Степень влияния телевидения и литературы (чтения книг) на развитие личности подростка
Степень влияния телевидения и литературы (чтения книг) на развитие личности подростка Захист нафтогазопромислового обладнання від корозії з використанням інгібіторів. Оцінка ефективності дії інгібіторів
Захист нафтогазопромислового обладнання від корозії з використанням інгібіторів. Оцінка ефективності дії інгібіторів Классный час. Тема Дружба
Классный час. Тема Дружба Прогноз ветра и связанных с ним явлений погоды
Прогноз ветра и связанных с ним явлений погоды Доклад директора ГБУ Жилищник района Котловка
Доклад директора ГБУ Жилищник района Котловка Технология дистанционного обучения
Технология дистанционного обучения в Лекция 6
в Лекция 6