Содержание
- 2. Электронная структура атома углерода в органических соединениях
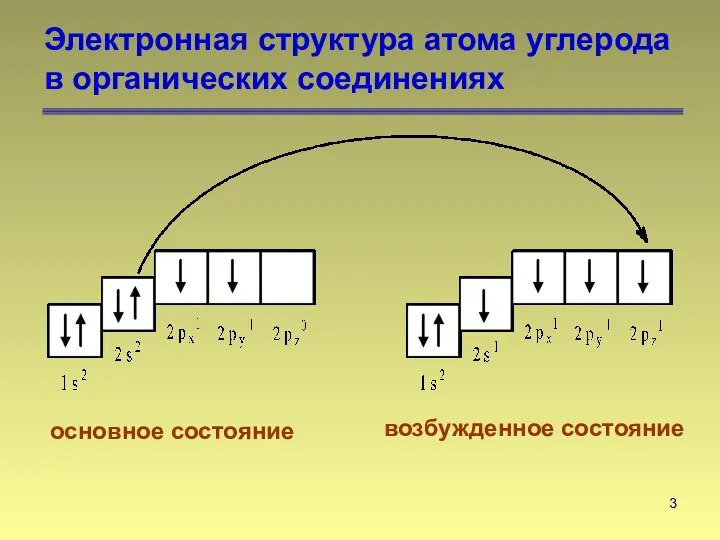
- 3. Электронная структура атома углерода в органических соединениях основное состояние возбужденное состояние
- 4. Электронная структура атома углерода в органических соединениях
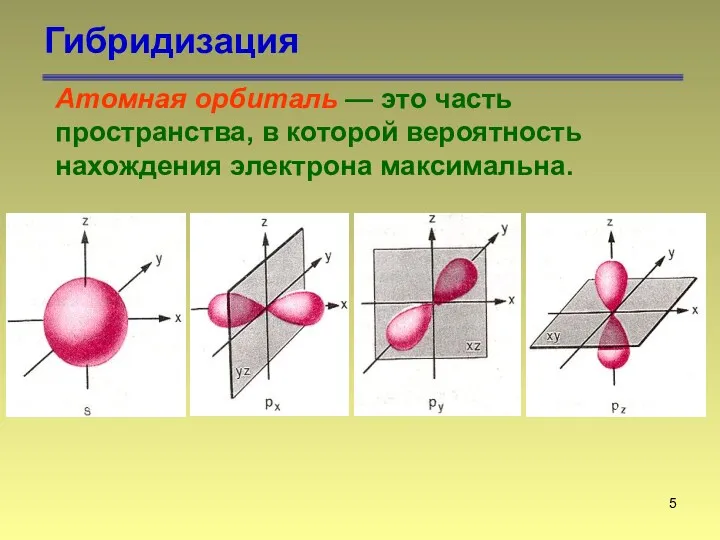
- 5. Гибридизация Атомная орбиталь — это часть пространства, в которой вероятность нахождения электрона максимальна.
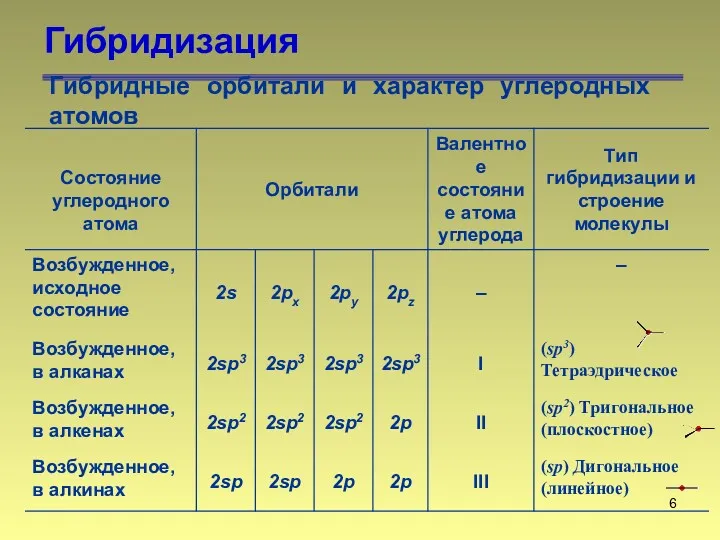
- 6. Гибридизация Гибридные орбитали и характер углеродных атомов
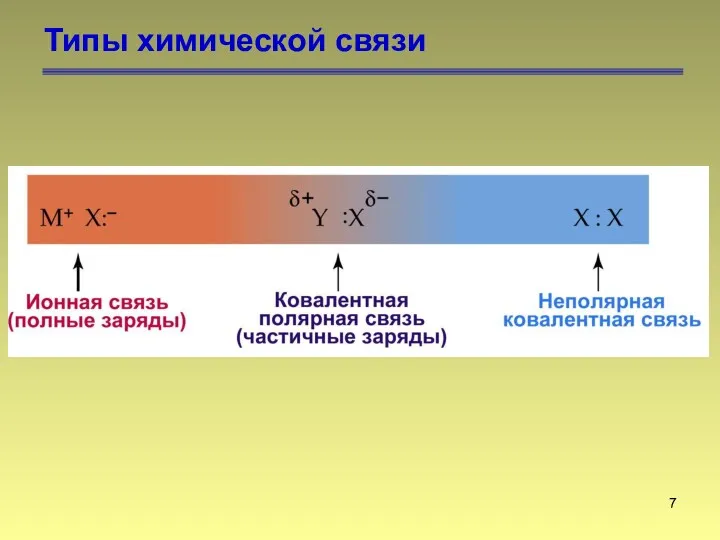
- 7. Типы химической связи
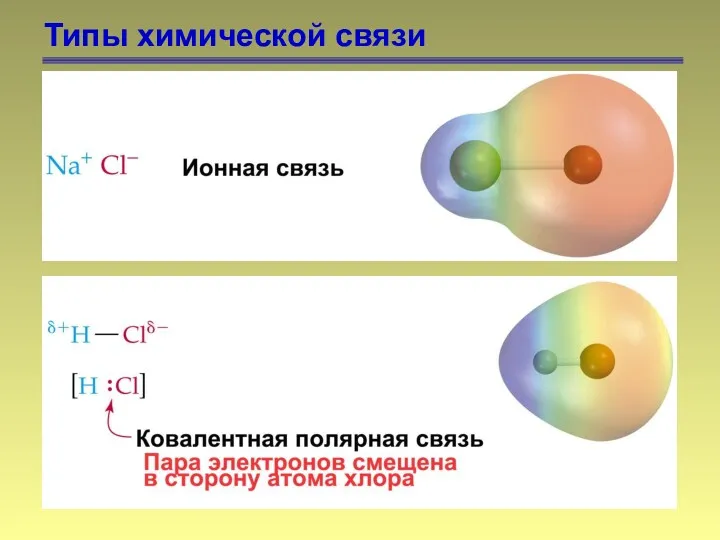
- 8. Типы химической связи
- 9. Типы химической связи
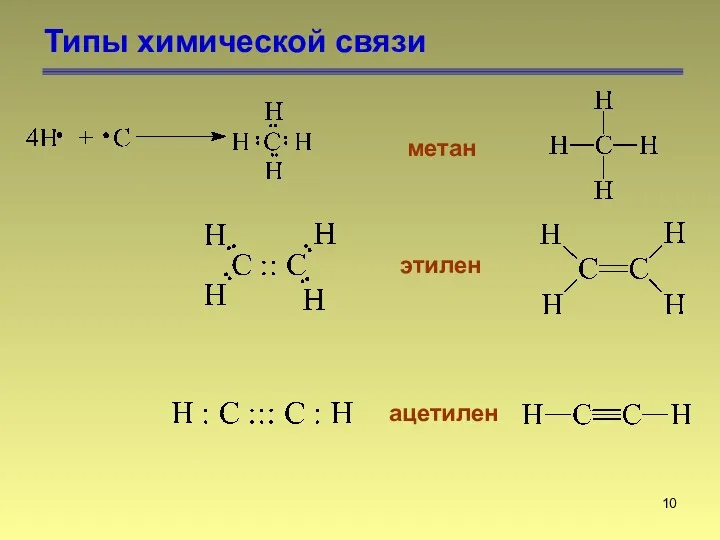
- 10. Типы химической связи метан этилен ацетилен
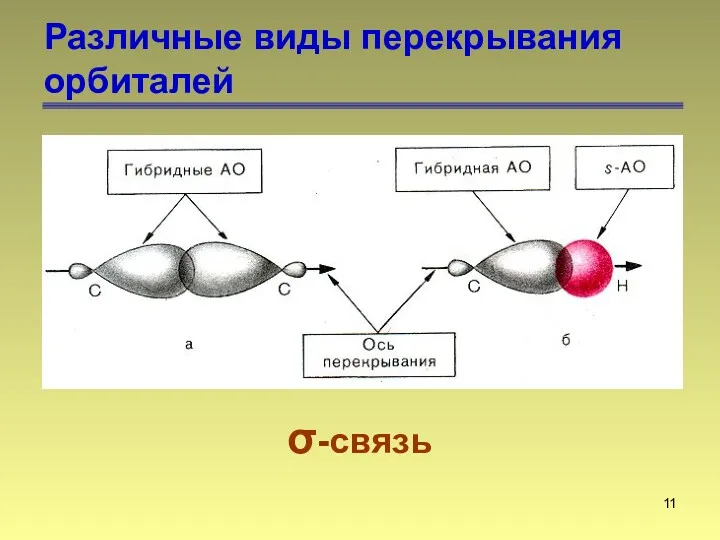
- 11. Различные виды перекрывания орбиталей σ-связь
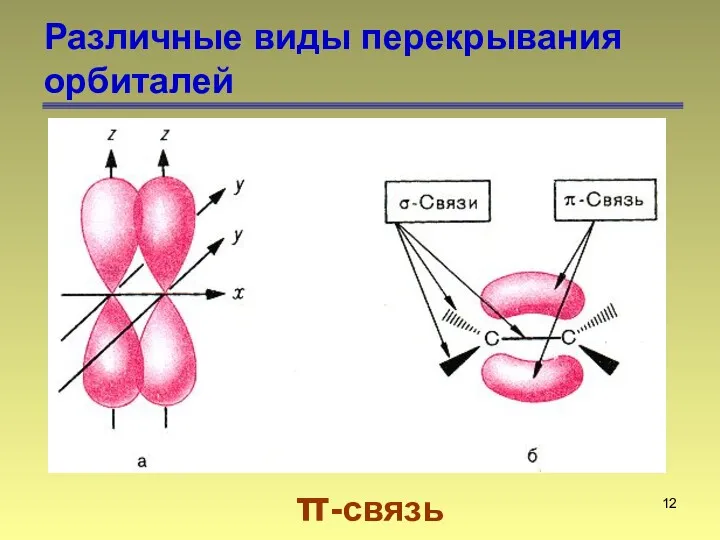
- 12. Различные виды перекрывания орбиталей π-связь
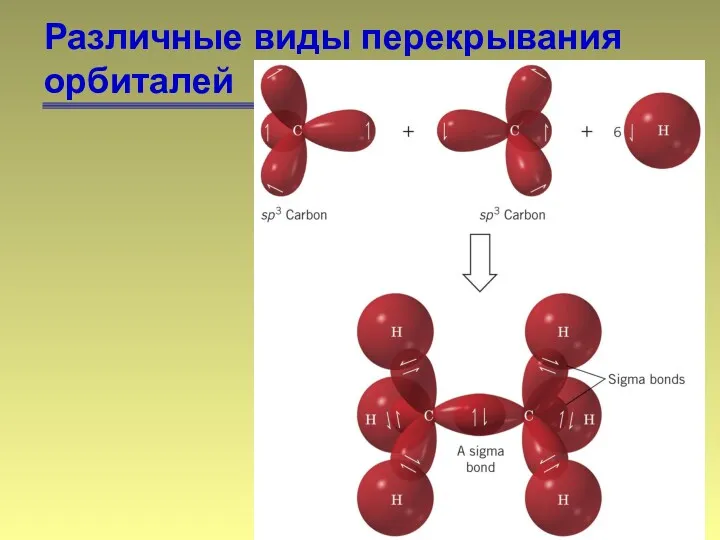
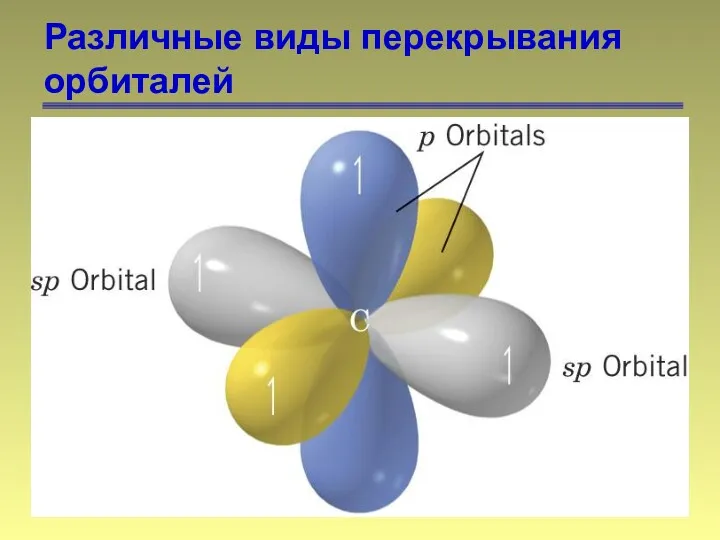
- 13. Различные виды перекрывания орбиталей
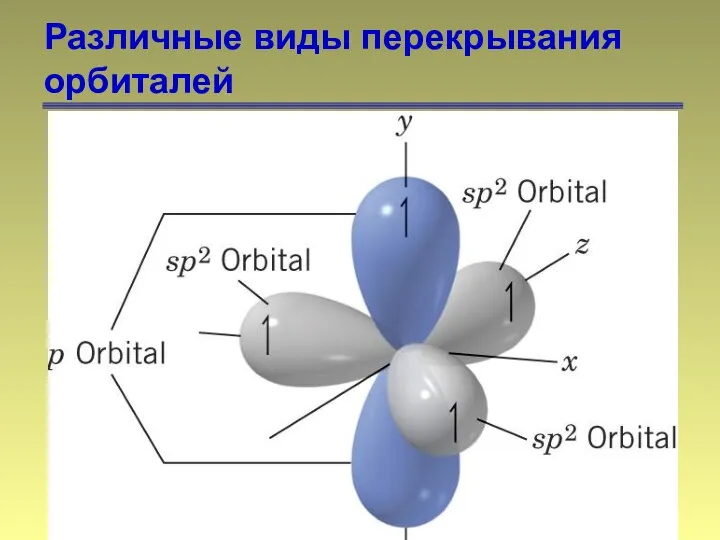
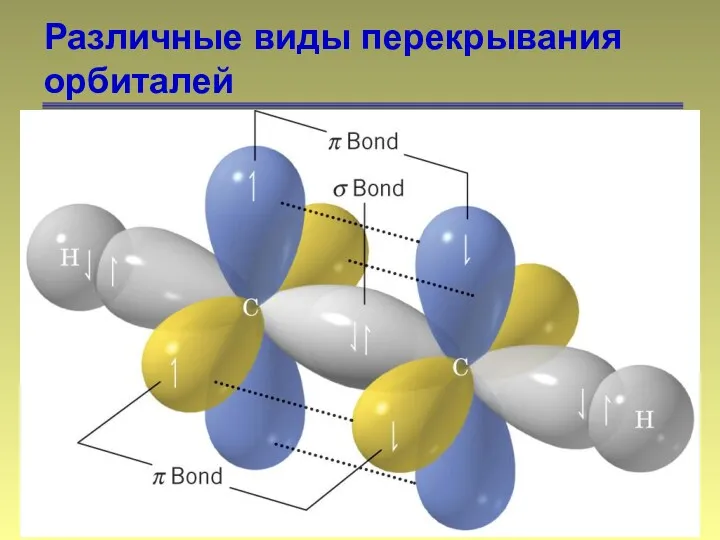
- 14. Различные виды перекрывания орбиталей
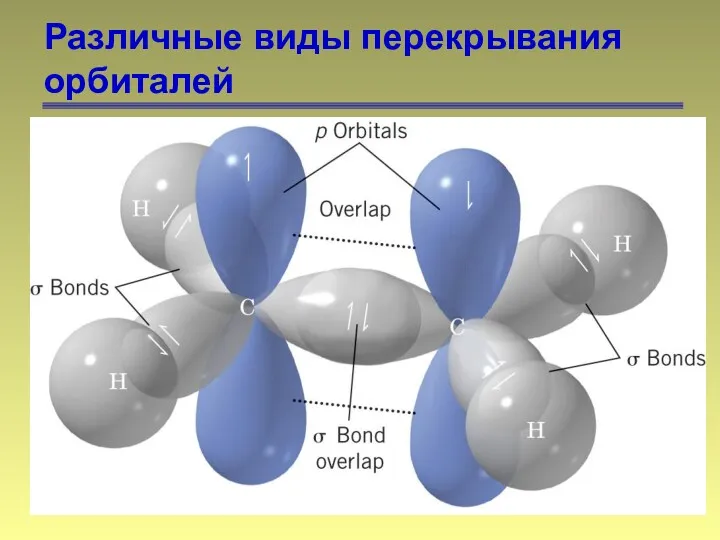
- 15. Различные виды перекрывания орбиталей
- 16. Различные виды перекрывания орбиталей
- 17. Различные виды перекрывания орбиталей
- 18. Свойства ковалентной связи Ковалентная связь характеризуется несколькими параметрами: полярностью, длиной, энергией и направленностью в пространстве (углами
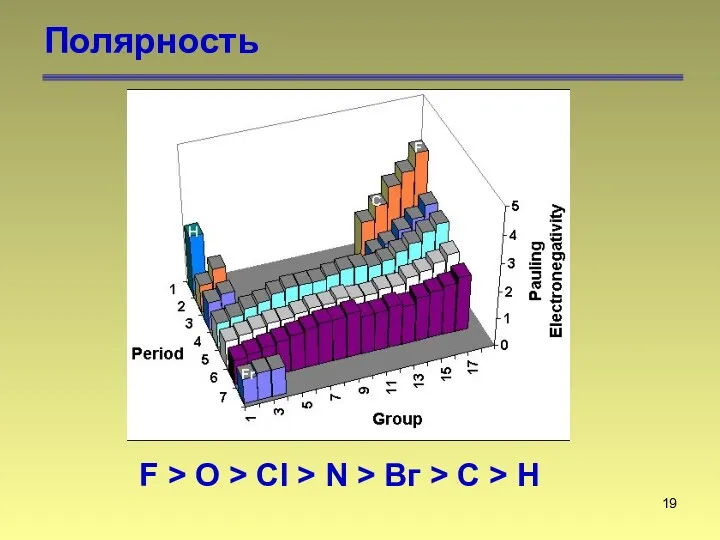
- 19. Полярность F > O > Сl > N > Вг > С > Н
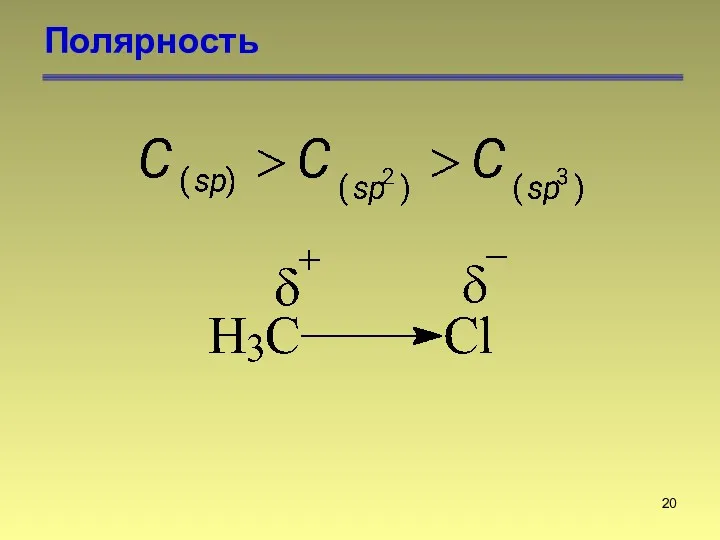
- 20. Полярность
- 21. Поляризуемость Ковалентная связь обладает поляризуемостью — способностью изменять свою полярность, например, под влиянием внешнего воздействия. π-связи
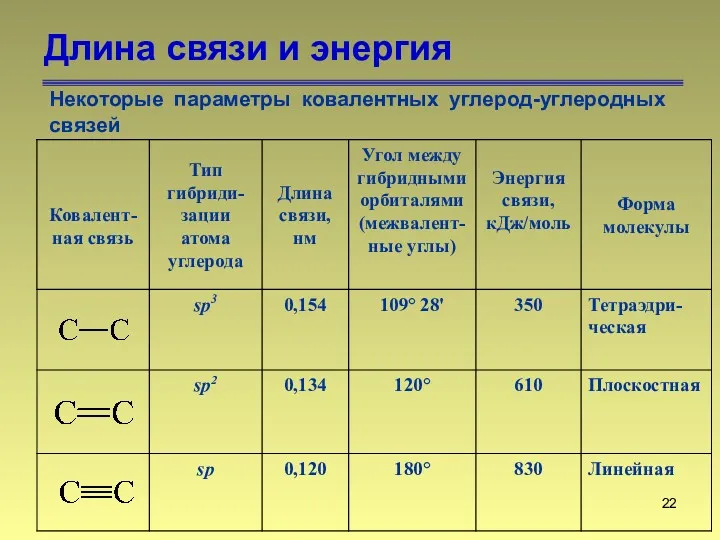
- 22. Длина связи и энергия Некоторые параметры ковалентных углерод-углеродных связей
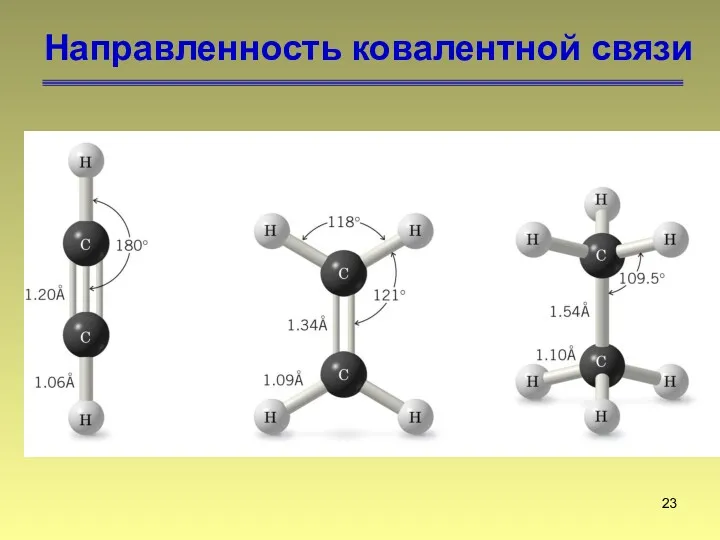
- 23. Направленность ковалентной связи
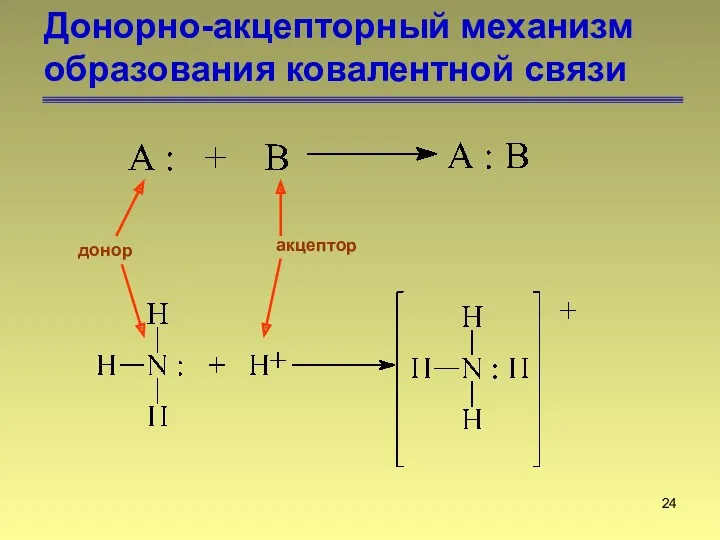
- 24. Донорно-акцепторный механизм образования ковалентной связи донор акцептор
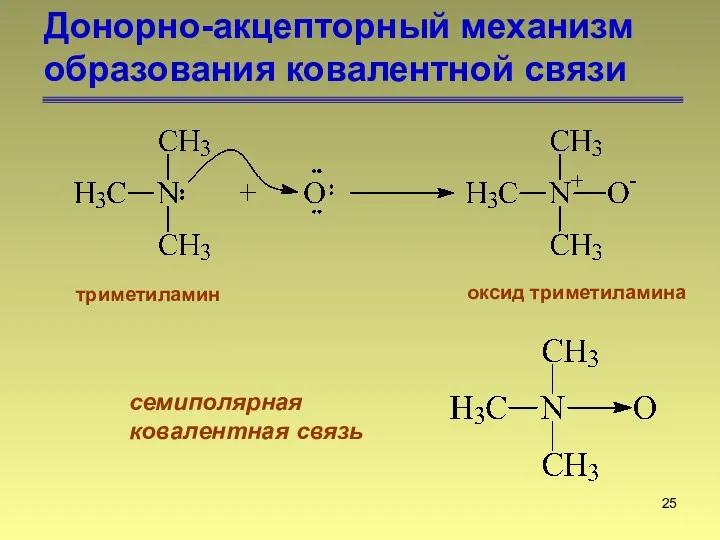
- 25. Донорно-акцепторный механизм образования ковалентной связи триметиламин оксид триметиламина семиполярная ковалентная связь
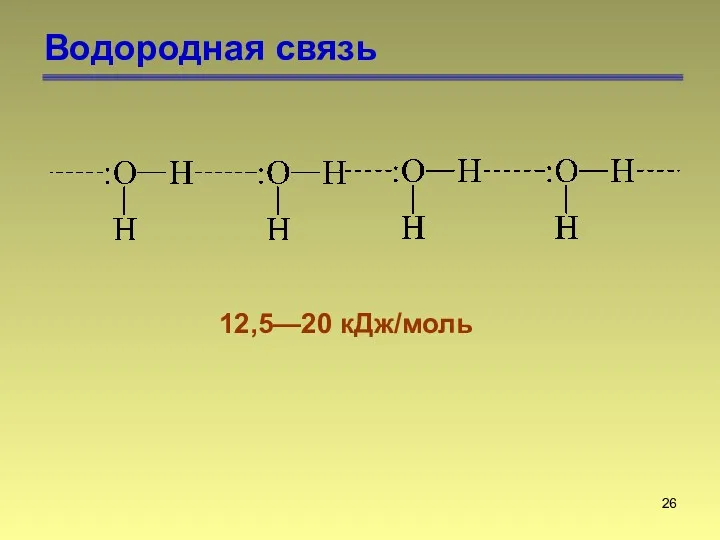
- 26. Водородная связь 12,5—20 кДж/моль
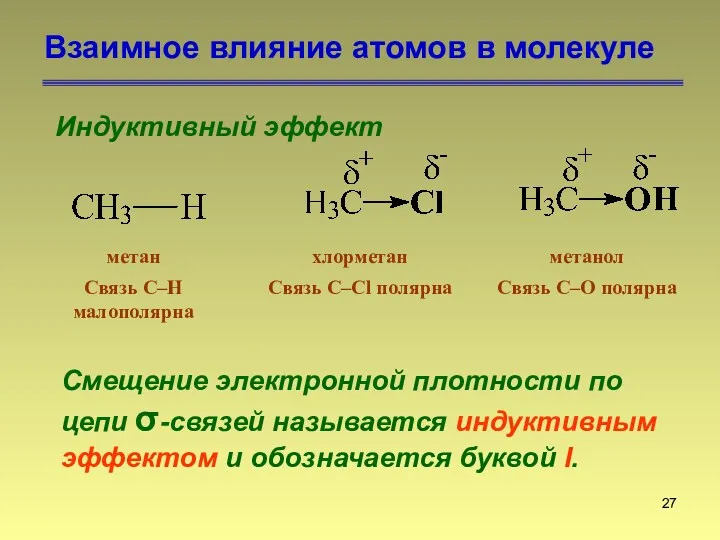
- 27. Взаимное влияние атомов в молекуле Индуктивный эффект Смещение электронной плотности по цепи σ-связей называется индуктивным эффектом
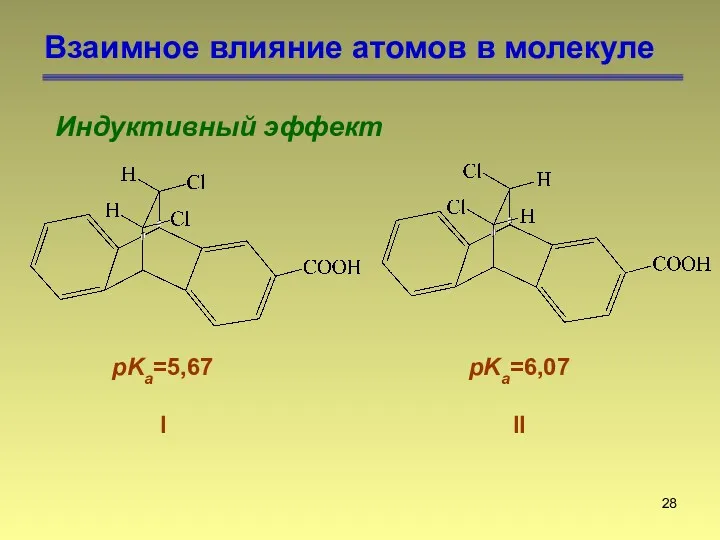
- 28. Взаимное влияние атомов в молекуле Индуктивный эффект pKa=5,67 I pKa=6,07 II
- 29. Взаимное влияние атомов в молекуле Индуктивный эффект Электроноакцепторные заместители, т.е. атом или группа атомов, смещающие электронную
- 30. Взаимное влияние атомов в молекуле Индуктивный эффект +I-Эффект проявляют алифатические углеводородные радикалы, т.е. алкильные радикалы (–CH3,
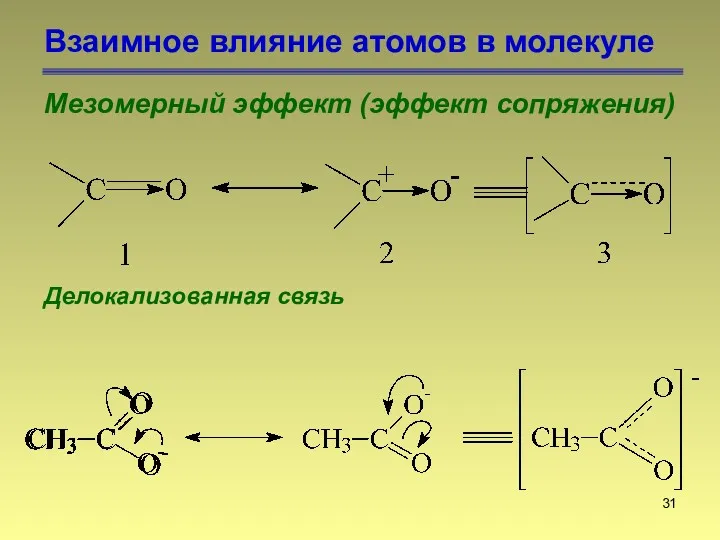
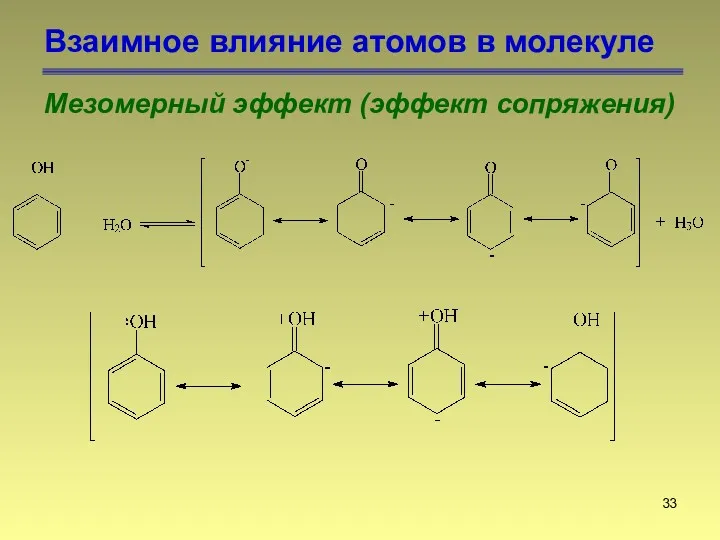
- 31. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения) Делокализованная связь
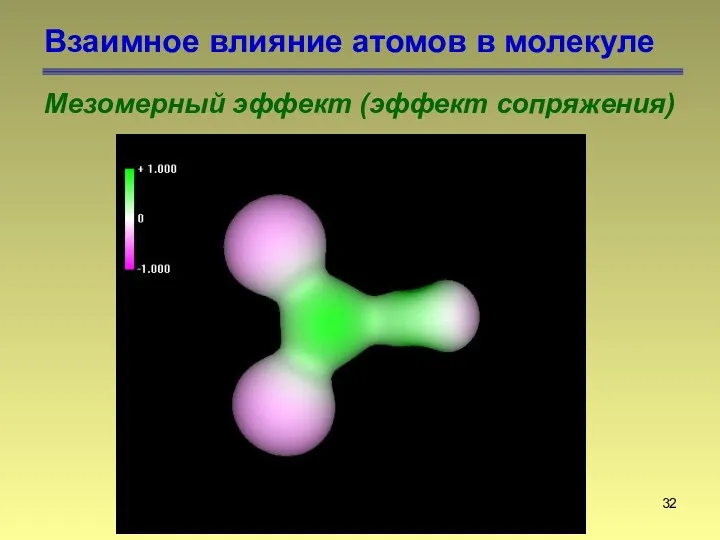
- 32. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения)
- 33. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения)
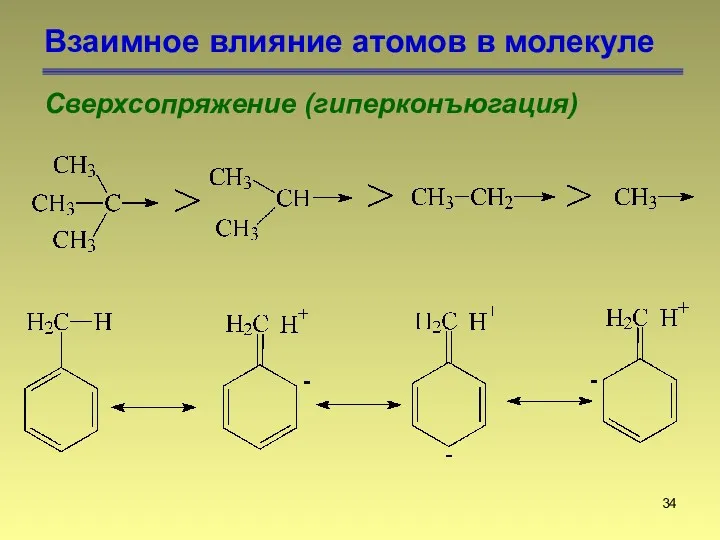
- 34. Взаимное влияние атомов в молекуле Сверхсопряжение (гиперконъюгация)
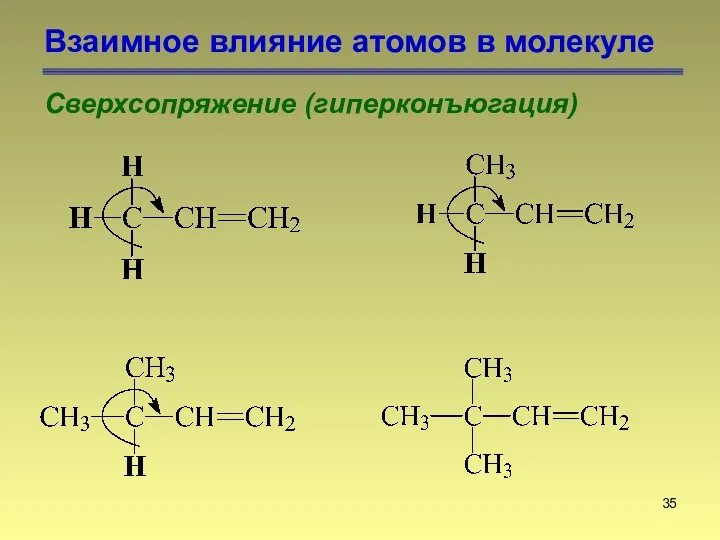
- 35. Взаимное влияние атомов в молекуле Сверхсопряжение (гиперконъюгация)
- 37. Скачать презентацию






 Фотоальбом. Машенька
Фотоальбом. Машенька Международные и региональные торговые сети
Международные и региональные торговые сети Презентация к уроку Деление клетки. Митоз. естествознание-5 класс
Презентация к уроку Деление клетки. Митоз. естествознание-5 класс символы и эмблемы
символы и эмблемы Шаблоны презентаций - 5
Шаблоны презентаций - 5 Окна. Оконные проёмы. Варианты оформления
Окна. Оконные проёмы. Варианты оформления Методы оценки экономической эффективности инвестиционных проектов и их реализация в программном обеспечении
Методы оценки экономической эффективности инвестиционных проектов и их реализация в программном обеспечении G`alamat online school
G`alamat online school Система комп’ютерного моделювання процесів життєдіяльності органів і систем організму, Скіф
Система комп’ютерного моделювання процесів життєдіяльності органів і систем організму, Скіф Назначение, общее устройство и тактико-технические характеристики РСМ Р-166 (Р-166-0,5)
Назначение, общее устройство и тактико-технические характеристики РСМ Р-166 (Р-166-0,5) דור המייסדים - יונג ואדלר
דור המייסדים - יונג ואדלר Виды перевозок пассажиров автомобильным транспортом
Виды перевозок пассажиров автомобильным транспортом Бактериялар
Бактериялар Всемирный день без табака
Всемирный день без табака Функции рекламы и PR в организации
Функции рекламы и PR в организации Обустройство морских нефтегазовых месторождений
Обустройство морских нефтегазовых месторождений Основные теоремы магнитостатического поля
Основные теоремы магнитостатического поля Внутренние воды РТ
Внутренние воды РТ Генеральный план
Генеральный план prezentatsia
prezentatsia Управление экономической безопасности и противодействия коррупции. УЭБиПК УМВД России по Ульяновской области
Управление экономической безопасности и противодействия коррупции. УЭБиПК УМВД России по Ульяновской области Вопросы репродуктивного здоровья, современные методы обследования и лечения бесплодия
Вопросы репродуктивного здоровья, современные методы обследования и лечения бесплодия Современные технологии на уроках географии
Современные технологии на уроках географии Презентация Лоскутное шитье-неиссякаемый источник творчества
Презентация Лоскутное шитье-неиссякаемый источник творчества Гальваностегія. Приклад гальванізації сріблом (або золотом)
Гальваностегія. Приклад гальванізації сріблом (або золотом) Презентация День семьи
Презентация День семьи Новые подходы к изучению истории Великой Отечественной войны и их отражение в школьных учебниках
Новые подходы к изучению истории Великой Отечественной войны и их отражение в школьных учебниках Внутренние воды Пензенской области
Внутренние воды Пензенской области