Содержание
- 2. Свойства растворов электролитов Вещества, растворы и расплавы которых проводят электрический ток, называют электролитами. Свойства растворов электролитов
- 3. Теории кислот и оснований Электролитическая теория (теория Арениуса). Протолитическая теория (Бренстеда – Лоури). Электронная теория (теория
- 4. Электролитическая теория Предложена шведским ученым Сванте Арениусом, который утверждал, что: при отсутствии электрического тока в растворе
- 5. Электролитическая теория под действием электрического тока положительно заряженные ионы движутся к катоду (катионы), отрицательно заряженные –
- 6. Диссоциация кислот Кислоты – электролиты, которые при диссоциации в водных растворах дают катионы водорода (гидроксония Н3О+)
- 7. Диссоциация оснований Основания – электролиты, которые при диссоциации в водных растворах образуют катион металла и анионы
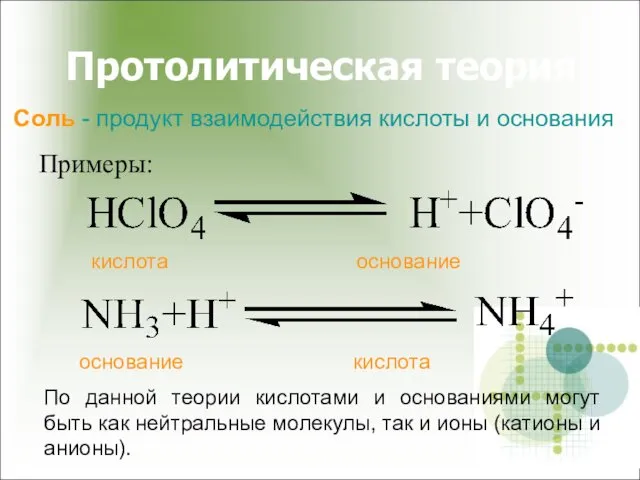
- 8. Диссоциация солей Соли – электролиты, которые при диссоциации в водных растворах дают катионы металлов, NH4+ и
- 9. Ионные уравнения реакций Согласно с теорией электролитической диссоциации реакции в растворах электролитов проходят с участием ионов
- 10. Протолитическая теория Датский физико-химик Йоханнес Бренстед и английский химик Томас Лоури в 1928-1929 г. предложили протолитическую
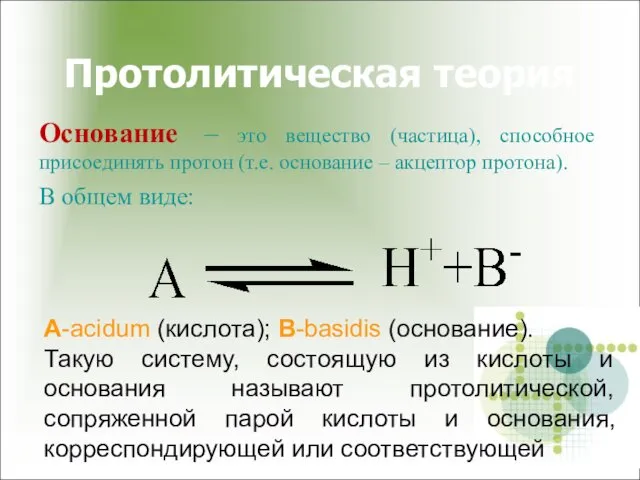
- 11. Протолитическая теория Основание – это вещество (частица), способное присоединять протон (т.е. основание – акцептор протона). В
- 12. Протолитическая теория Примеры: кислота основание основание кислота По данной теории кислотами и основаниями могут быть как
- 13. Электронная теория Предложена в 1926 г. американским ученым Гилбертом Льюисом. Согласно данной теории: Кислотами называют соединения,
- 14. Электронная теория В результате данного взаимодействия кислота и основание взаимодействуют между собой с образованием связи по
- 15. Степень диссоциации Электролиты по разному диссоциируют в растворе. Количественной характеристикой распада молекул на ионы есть степень
- 16. Степень диссоциации Степень диссоциации определяют экспериментально по значениям электропроводности растворов электролитов различной концентрации или по величине
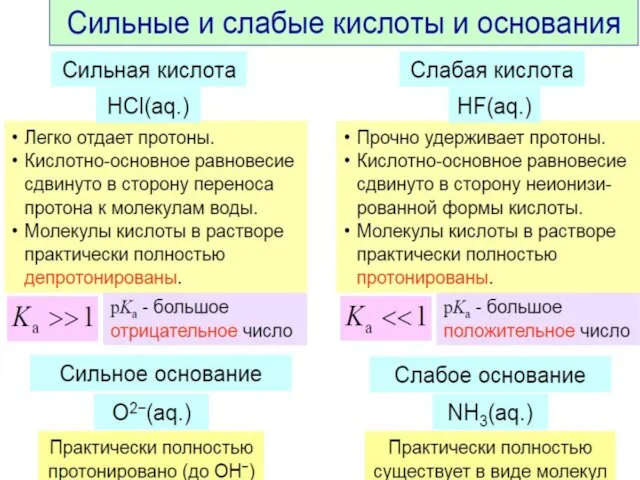
- 17. Свойства растворов сильных электролитов В растворах сильных электролитов концентрацию заменяют на активность (обозначает эффективную, условную концентрацию,
- 18. Коэффициент активности. Ионная сила раствора Коэффициент активности ионов есть функцией не только концентрации ионов. Он также
- 19. Равновесие в растворах слабых электролитов Для уравнения диссоциации слабого электролита КА: К2А 2К++А- Выражение для константы
- 20. Закон разбавления Оствальда: Т.к. в растворах слабых электролитов степень диссоциации очень малая величина, то 1-а=1, тогда
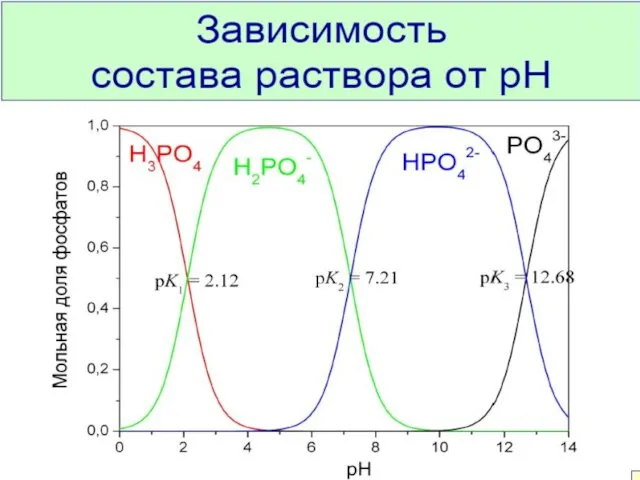
- 21. Константы кислотности и основности Константы диссоциации кислот и оснований называют соответственно константами кислотности (КА) и основности
- 24. Диссоциация воды. Ионное произведение воды. Экспериментально установлено, что вода проводит электрический ток: Н2О=Н++ОН-, или 2Н2О=Н3О++ОН- Кд(Н2О)=1,8*10-16,
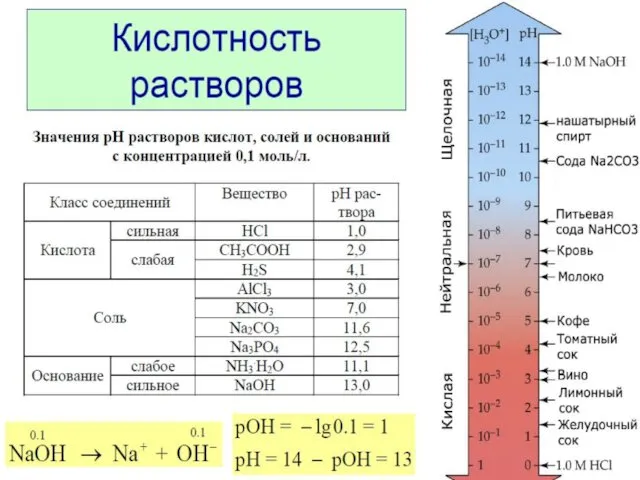
- 25. Водородный показатель Водородным показателем рН называют отрицательный десятичный логарифм концентрации ионов водорода: рН=-lg[H+] или [H+]=10-рН рН+рОН=14
- 26. Измерение pH Индикаторы pH - метры
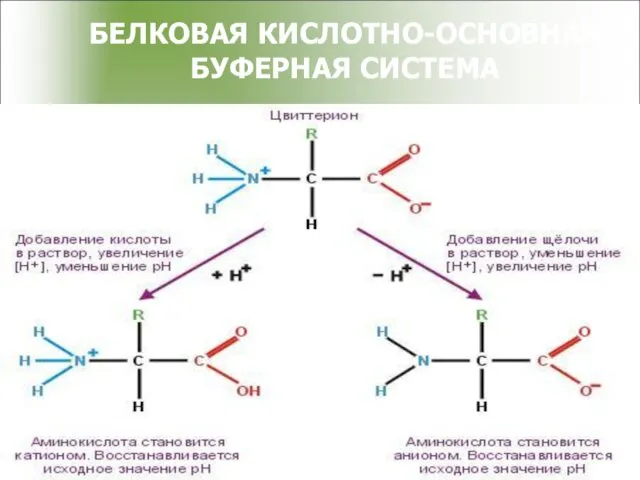
- 28. Буферным называют раствор, содержащий смесь какой-либо слабой кислоты и ее растворимой соли. Являясь компонентами буферных систем
- 30. Ацетатный буферный раствор (рН 3,7-5,6) СН3СООNa→СН3СОО- + Na+ СН3СООH ↔ СН3СОО- + H+ Константа диссоциации Ка
- 31. Уравнение Гендерсона - Гассельбаха рН = рКа – lg [кислота ] [основание ] рН = рКа
- 32. Механизм буферного действия ацетатного буфера СН3СООNa→СН3СОО- + Na+(полностью диссоциирует) СН3СООH ↔ СН3СОО- + H+ (частично диссоциирует)
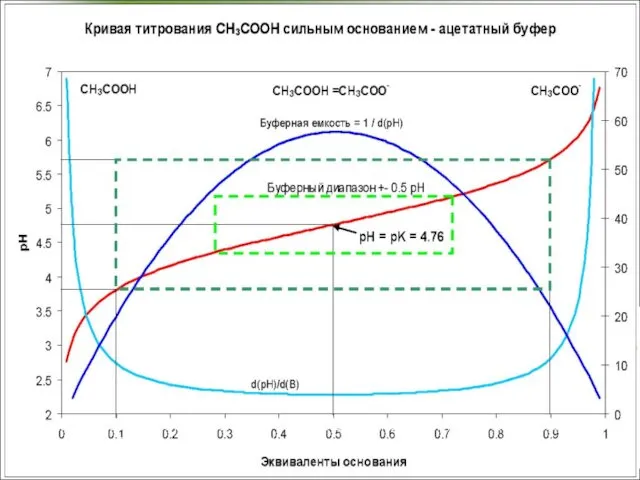
- 33. Буферная емкость определяется количеством эквивалентов сильной кислоты или основания, которые необходимо добавить к 1 л буферного
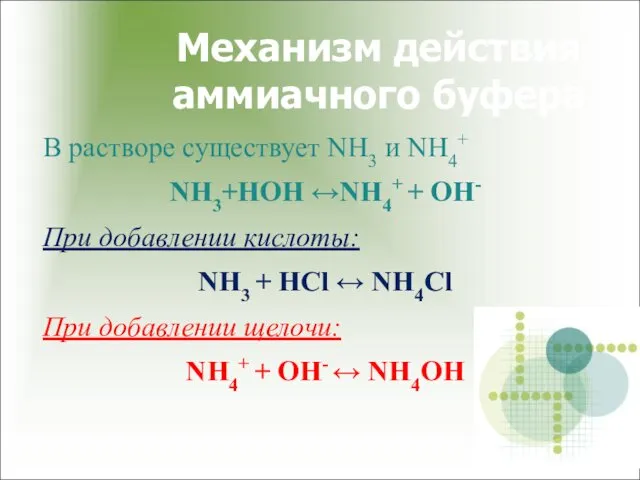
- 34. Аммиачный буфер (диапазон рН 8,4-10,3) NH4OH ↔ NH4+ + OH- NH4Cl → NH4+ + Cl- Уравнение
- 35. Механизм действия аммиачного буфера В растворе существует NH3 и NH4+ NH3+НОН ↔NH4+ + ОН- При добавлении
- 36. Влияние разведения на рН буферных растворов Из уравнения Гендерсона Гассельбаха видно, что при разведении растворов концентрации
- 37. Буферная емкость Буферная емкость (В) - это число молей эквивалента сильной кислоты или щелочи, которое необходимо
- 38. Буферная емкость Буферная емкость максимальна при соотношении кислоты и соли 1:1 => pH = pK. Хорошая
- 41. Механизм действия фосфатного буфера: 1. при добавлении кислоты 2 Na++HPO42–+H++Cl -→ NaH2PO4+Na++Cl - 2. при добавлении
- 42. Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Буферные системы плазмы крови
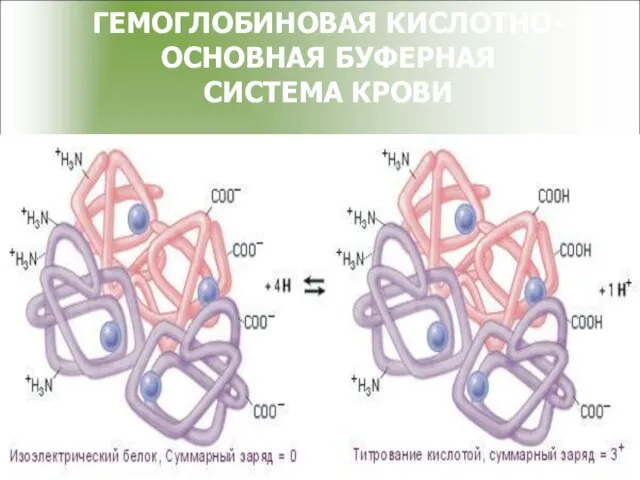
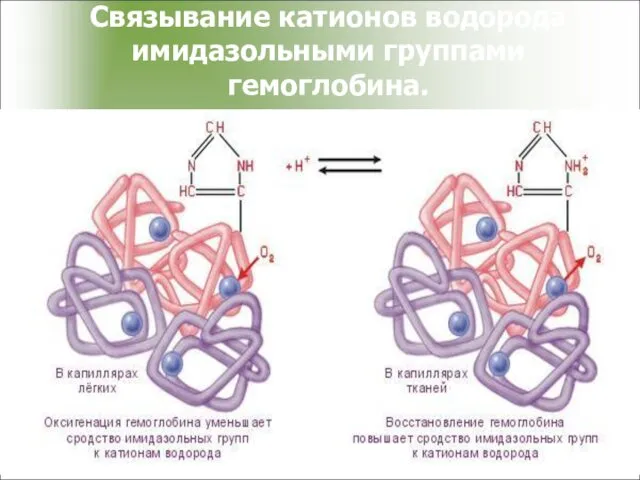
- 43. ГЕМОГЛОБИНОВЫЙ БУФЕР: где HHb — дезоксигемоглобин; HHbO2 — оксигемоглобин; KHb — калиевая соль дезоксигемоглобина; KHbO2 —
- 44. Механизм действия гемоглобинового буфера 1. Гемоглобин является белком, он амфотерен COO- COOH Pt + H +
- 45. ГЕМОГЛОБИНОВАЯ КИСЛОТНО-ОСНОВНАЯ БУФЕРНАЯ СИСТЕМА КРОВИ
- 46. Связывание катионов водорода имидазольными группами гемоглобина.
- 47. БЕЛКОВАЯ КИСЛОТНО-ОСНОВНАЯ БУФЕРНАЯ СИСТЕМА
- 48. В тканях и лёгких протекают следующие процессы: 1. В тканях: KHb + H2CO3 → HHb +
- 49. Кислотно-основное состояние организма и его нарушения Ацидоз - это уменьшение кислотной буферной емкости физиологической системы по
- 51. Скачать презентацию




















![Водородный показатель Водородным показателем рН называют отрицательный десятичный логарифм концентрации ионов водорода: рН=-lg[H+] или [H+]=10-рН рН+рОН=14](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/50207/slide-24.jpg)

















 Презентация История появления газет 3-4 класс
Презентация История появления газет 3-4 класс Организация эксплуатации объектов, сооружений и оборудования
Организация эксплуатации объектов, сооружений и оборудования Информация и управление полиграфической системой
Информация и управление полиграфической системой Буклет Психология
Буклет Психология Алгоритмы решения рациональных уравнений
Алгоритмы решения рациональных уравнений Необычные растения и животные в природе.
Необычные растения и животные в природе. Учитель математики
Учитель математики Организация производства
Организация производства Борис Заходер - поэт, переводчик, советский писатель
Борис Заходер - поэт, переводчик, советский писатель Проектная деятельность учащихся.Из опыта работы.
Проектная деятельность учащихся.Из опыта работы. Задачи, решаемые техническим заказчиком, застройщиком на этапе разработки комплекта рабочей документации (РД) для СМР
Задачи, решаемые техническим заказчиком, застройщиком на этапе разработки комплекта рабочей документации (РД) для СМР Жилой дом блокированной застройки на две семьи
Жилой дом блокированной застройки на две семьи Советы для начинающих. Как сделать хорошую презентацию
Советы для начинающих. Как сделать хорошую презентацию Автоматическая подстройка частоты в автогенераторах. Лекция 15
Автоматическая подстройка частоты в автогенераторах. Лекция 15 Безопасность и правила дорожного движения
Безопасность и правила дорожного движения Особенности обретения трезвости и опыт переживания аддиктивного влечения у отцов - основателей сообщества А.А.
Особенности обретения трезвости и опыт переживания аддиктивного влечения у отцов - основателей сообщества А.А. Валянцін Лукша
Валянцін Лукша План квартиры с привязкой перегородок
План квартиры с привязкой перегородок Внеурочная деятельность Дети и война музыкально- литературная композиция
Внеурочная деятельность Дети и война музыкально- литературная композиция Общее имущество собственников помещений в многоквартирном доме. Состав общего имущества в многоквартирном доме
Общее имущество собственников помещений в многоквартирном доме. Состав общего имущества в многоквартирном доме Александр Сергеевич Даргомыжский
Александр Сергеевич Даргомыжский Крымская война 1853—1856 годов
Крымская война 1853—1856 годов Популярные мифы о COVID-19
Популярные мифы о COVID-19 МК - Мышка
МК - Мышка Игра, как основа социального развития детей
Игра, как основа социального развития детей Заболевания сердечно-сосудистой системы и их предупреждение
Заболевания сердечно-сосудистой системы и их предупреждение ЗДОРОВЬСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ НА УРОКАХ ГЕОГРАФИИ
ЗДОРОВЬСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ НА УРОКАХ ГЕОГРАФИИ о чём рассказывает музыка
о чём рассказывает музыка